
在淀粉KI溶液中,滴入少量NaClO溶液,溶液立即变蓝,有关反应的离子方程式是 . 在上述蓝色溶液中,继续滴加足量的NaClO溶液,蓝色逐渐消失,有关反应的离子方程式是 .(提示:碘元素被氧化成IO3﹣)从以上实验可知,ClO﹣、I2、IO3﹣的氧化性由强到弱的顺序是 .
考点: 氧化性、还原性强弱的比较.
分析: 在淀粉KI溶液中,滴入少量NaClO溶液,溶液立即变蓝,说明I﹣和ClO﹣发生氧化还原反应生成I2,继续滴加足量的NaClO溶液,蓝色逐渐消失,说明I2和ClO﹣发生氧化还原反应生成生成IO3﹣,自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,据此判断氧化性强弱.
解答: 解:在淀粉KI溶液中,滴入少量NaClO溶液,溶液立即变蓝,说明I﹣和ClO﹣发生氧化还原反应生成I2,I元素化合价由﹣1价变为0价、Cl元素化合价由+1价变为﹣1价,离子方程式为2I﹣+ClO﹣+H2O=I2+Cl﹣+2OH﹣,该反应中氧化剂是ClO﹣、氧化产物是I2,所以氧化性ClO﹣>I2;
继续滴加足量的NaClO溶液,蓝色逐渐消失,说明I2和ClO﹣发生氧化还原反应生成生成IO3﹣,I元素化合价由0价变为+5价、Cl元素化合价由+1价变为﹣1价,离子方程式为I2+5ClO﹣+2OH﹣=2 IO3﹣+5Cl﹣+H2O,氧化剂是ClO﹣,还原剂是I2,氧化产物是 IO3﹣,所以氧化性ClO﹣>IO3﹣>I2;
故答案为:2I﹣+ClO﹣+H2O=I2+Cl﹣+2OH﹣;I2+5ClO﹣+2OH﹣=2 IO3﹣+5Cl﹣+H2O;ClO﹣>IO3﹣>I2.
点评: 本题考查氧化性强弱比较,明确元素化合价变化及基本概念、基本规律即可解答,知道常见元素化合价,侧重考查学生对基本概念、基本理论的理解,题目难度不大.


科目:高中化学 来源: 题型:
下列物质中含有原子数由多到少排列正确的是()
①0.1mol H2SO4 ②4.8g氢气 ③5.6L标准状况下NH3 ④4℃时5.4mL H2O.
A. ①>②>③>④ B. ②>③>④>① C. ②>①>③>④ D. ③>①>④>②
查看答案和解析>>
科目:高中化学 来源: 题型:
NO2通过盛有水的洗气瓶,转移0.02mol电子时,参加反应的NO2气体在标准状况下的体积为()
A. 224mL B. 336mL C. 448mL D. 672mL
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法中不正确的是()
A. 一定量的Fe与含1molHNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B. 1molFeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C. 0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA
D. 125gCuSO4•5H2O晶体中含有0.5NA个Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2•6H2O晶体后,仍能大量共存的是()
A. Na+、H+、Cl﹣、NO3﹣ B. Na+、Mg2+、Cl﹣、SO42﹣
C. K+、Ba2+、OH﹣、I﹣ D. Cu2+、CO32﹣、Br﹣、ClO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组探究SO2气体还原Fe,I2,他们使用的药品和装置如如所示.
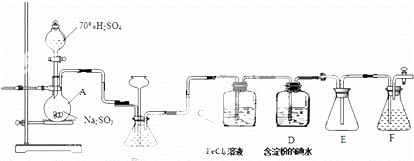
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若 ,则整个装置气密性良好.装置E的作用是 .装置F中为NaOH溶液.
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 .
a.蒸馏水
b.饱和Na2SO3溶液
c.饱和NaHSO3溶液
d.饱和NaHCO3溶液
(3)SO2气体还原Fe3+反应的产物是 (填离子符号).
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去.
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀.
上述方案不合理的是方案①,原因是 .
(5)能表明I﹣的还原性弱于SO2的现象是 ,写出有关离子方程式: ﹣.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 单位物质的量的气体所占的体积就是气体摩尔体积
B. 摩尔是物质的量的单位
C. 阿伏加德罗常数就是6.02×1023
D. CO2的摩尔质量为44g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量
B. 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
C. 书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态
D. 凡是化合反应都是放热反应,分解反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子既能与镁粉反应,又能大量共存,且其溶液为无色溶液的是( )
A. Ca2+、Cl﹣、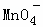 、Na+ B. K+、Cl﹣、
、Na+ B. K+、Cl﹣、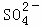 、H+
、H+
C. OH﹣、Na+、Al3+、I﹣ D. H+、Cl﹣、Ba2+、Ag+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com