
【题目】摩尔盐( (NH4)2Fe(SO4)2·6H2O)广泛用于化学分析。溶于水,不溶于乙醇,在空气中比硫酸亚铁稳定,有还原性。现以废铁屑等为原料制备摩尔盐,并对产品中相关离子进行检测。
(一)制备过程如下:
步骤1:将废铁屑置于热的纯碱溶液中,充分浸泡后过滤、洗涤。
步骤2:向步骤1的滤渣中加入适量稀硫酸,到剩余少量固体为止。过滤。
步骤3:向步骤2的滤液中加入稍过量的(NH4)2SO4饱和溶液。
步骤4:小火蒸发到有晶膜出现,停止加热,冷却后过滤。
步骤5:将步骤4的滤渣洗涤,干燥,得到产品。
回答下列问题:
(1)步骤1中主要是利用纯碱溶液的碱性除去油污。写出纯碱溶液显碱性的主要的离子方程式:__________________________________ 。
(2)步骤1中,也可以用倾析法代替过滤,操作如图所示。下列适合用倾析法分离的是________

a.沉淀颗粒较大 b.沉淀容易沉降
c.沉淀呈胶状 d.沉淀呈絮状
(3)步骤4不直接蒸干的理由是___________________________________________。
(4)步骤5中,洗涤沉淀用的洗涤剂是_____________。
(二)产品中NH4+、Fe2+的检测。
(5)NH4+的定性检测:取少量产品于试管中,加水溶解,_______________________ ,证明样品中含有NH4+(填操作及现象)。
(6)测定产品中Fe2+的含量:称取10.0g产品,溶于水,加入足量NaOH溶液。过滤、洗涤、灼烧、冷却、称量。重复灼烧、冷却、称量,直到_______________为止。称量固体质量为2.0g。产品中Fe2+的质量分数为_______。
(7)己知Li2Ti5O15和Na2O2中都含有过氧键,Ti的化合价为+4,Na2O2中含有一个过氧键,则Li2Ti5O15中过氧键的数目为__________。
【答案】CO32-+H2O ![]() HCO3-+OH- ab 提高产品的纯度(或减少产品中的杂质) 乙醇 向所得溶液中加入浓的氢氧化钠溶液,加热,产生使湿润的红色石蕊试纸变蓝的气体 最后两次的质量差不超过0.1克 14% 4
HCO3-+OH- ab 提高产品的纯度(或减少产品中的杂质) 乙醇 向所得溶液中加入浓的氢氧化钠溶液,加热,产生使湿润的红色石蕊试纸变蓝的气体 最后两次的质量差不超过0.1克 14% 4
【解析】
(1)纯碱水解呈碱性,且碱性主要来源于一级水解。
(2)倾析法是一种简易的固液分离方法,适用于沉淀颗粒较大,沉淀容易沉降的情形。
(3)由于摩尔盐是由硫酸盐铁和硫酸铵的混合溶液加热得到的,在加热过程中易析出硫酸亚铁、硫酸铵杂质,故不直接蒸干是为了提高产品的纯度(或减少产品中的杂质)。
(4)由题中信息可知,摩尔盐溶于水,不溶于乙醇,用水洗涤会降低产率,应用乙醇洗涤。
(5)检验NH4+的方法为向所得溶液中加入浓的氢氧化钠溶液,加热,置于试管口的湿润的红色石蕊试纸变蓝,则证明有NH4+。
(6)产品溶于水后与足量NaOH溶液反应,并将固体洗涤灼烧,并重复灼烧、冷却、称量。直到最后两次称量质量相等或相差不超过0.1克。
(7)根据化合物中正负化合价代数和为零的原则列出方程根据化合物中正负化合价代数和为零的原则列出方程即可解答。
(1)纯碱水解呈碱性,且碱性主要来源于一级水解,离子方程式为CO32-+H2O ![]() HCO3-+OH-,故答案为:CO32-+H2O
HCO3-+OH-,故答案为:CO32-+H2O ![]() HCO3-+OH-。
HCO3-+OH-。
(2)倾析法是一种简易的固液分离方法,适用于沉淀颗粒较大,沉淀容易沉降的情形,故ab正确,故选ab。
(3)由于摩尔盐是由硫酸盐铁和硫酸铵的混合溶液加热得到的,在加热过程中易析出硫酸亚铁、硫酸铵杂质,故不直接蒸干是为了提高产品的纯度(或减少产品中的杂质),故答案为:提高产品的纯度(或减少产品中的杂质)。
(4)由题中信息可知,摩尔盐溶于水,不溶于乙醇,用水洗涤会降低产率,应用乙醇洗涤,故答案为:乙醇。
(5)检验NH4+的方法为向所得溶液中加入浓的氢氧化钠溶液,加热,置于试管口的湿润的红色石蕊试纸变蓝,则证明有NH4+,故答案为:向所得溶液中加入浓的氢氧化钠溶液,加热,产生使湿润的红色石蕊试纸变蓝的气体。
(6)测定产品中Fe2+的含量时,产品溶于水后与足量NaOH溶液反应,并将固体洗涤灼烧,并重复灼烧、冷却、称量,直到最后两次称量质量相等或相差不超过0.1克,确保最终产物为Fe2O3,由题意可知最后得到2.0g固体,则其中铁元素的质量为2.0g×(56×2/56×2+16×3)=1.4g,根据质量守恒定律可知,铁元素全部来自产品中的Fe2+,故产品中的Fe2+的质量分数为(1.4g/10.0g)×100%=14%,故答案为:最后两次的质量差不超过0.1克;14%。
(7)设Li2Ti5O15的15个氧原子中-1价的氧有x个,根据化合物中正负化合价代数和为零的原则列出方程:1×2+4×5=x+2(15-x),解得x=8,两个-1价的氧原子构成一个过氧基,因此Li2Ti5O15过氧键的数目为8/2=4,故答案为:4。


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库。下图是人类从海水资源获取某些重要化工原料的流程示意图。
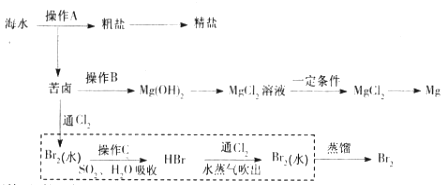
回答下列问题:
(1)操作A是_______________(填实验基本操作名称)。要知道海水晒盐的过程中溶液里食盐含量在逐渐提高的简易方法是__________________。
a.分析氯化钠含量 b.测定溶液密度 c.观察是否有沉淀析出
(2)操作B需加入下列试剂中的一种,最合适的是_____________。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳d.碳酸钠溶液
(3)上图中虚线框内流程的主要作用是_____________。写出溴水中通入SO2时反应的离子方程式____________
(4)上图中虚线框内流程也可用![]() Br2与Na2CO3反应的化学方程式补充完整:
Br2与Na2CO3反应的化学方程式补充完整:
![]() ___________
___________
(5)已知苦卤的主要成分如下:

理论上,1 L苦卤最多可得到Mg(OH)2的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化如图所示。
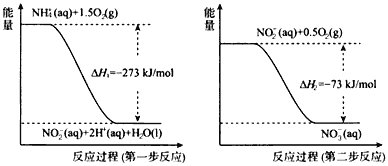
①第一步反应是____(填“放热”或“吸热”)反应。
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是______。
(2)已知,H2(g)+Br2(l)=2HBr (g) △H=-72kJ/mol,蒸发1molBr2(l)需要吸收的能量为30kJ,其它相关数据如下表:
物质 | H2(g) | Br2(g) | HBr (g) |
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为_____。
(3)研究NO2、SO2 、CO等大气污染气体的处理方法具有重要的意义。
已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH= -196.6 kJ·mol-1
2SO3(g) ΔH= -196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH= -113.0 kJ·mol-1
2NO2(g) ΔH= -113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=____kJ·mol-1;
SO3(g)+NO(g)的ΔH=____kJ·mol-1;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,向100mL含氯化氢14.6g的盐酸溶液中,放入5.6g纯铁粉,反应进行到2min末收集到氢气1.12 L(标准状况),在此后又经过4min,铁粉完全溶解。若不考虑溶液体积的变化,则:
(1)前2min内用FeCl2表示的平均反应速率是______________。
(2)后4min内用HCl表示的平均反应速率是________________。
(3)前2min与后4min相比,反应速率__________较快,其原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A 分子式为C2H4,可发生以下系列转化,已知B、D是生活中常见的两种有机物,下列说法不正确的是
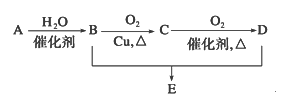
A. 75%的B溶液常用以医疗消毒
B. 由物质A到物质B发生的是加成反应
C. 物质B、D和E可以用饱和Na2CO3溶液鉴别
D. 由物质B、D制备E常用浓硫酸作脱水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PdCl2广泛用作催化剂和一些物质的检测试剂。由Pd(NH3)2Cl2制备PdCl2工艺流程如图所示。

(1)肼(N2H4)可以被看作二元弱碱,结合质子生成N2H5+或N2H62+。肼与少量稀硫酸混合后,得到产物的化学式为_____________。
(2)对工艺流程图中的滤液处理办法最好的是:______
a.返到提钯废液中,循环使用 b.转化为无毒物质后排放 c.深埋于地下
(3)王水溶钯时,Pd被氧化为H2PdCl4。同时得到唯一还原产物亚硝酰氯(NOCl)。反应消耗的HCl与HNO3的物质的量之比为_____。
(4)赶硝,是将残余的NO3-浓度降低到不大于0.04%。实验数据记录如下:

处理1吨Pd,需要用到HCl和MxOy的总体积至少为_______m3(合理选择表格里相关数据计算)。
(5)煅烧过程发生分解反应,化学方程式为:_______________________________。
(6)浸有磷钼酸铵溶液的氯化钯试纸遇微量CO立即变成蓝色。原理较为复杂,第一步是CO还原PdCl2得到Pd单质,同时有常见的氧化物生成。 写出反应原理中第一步的化学方程式:_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3A(g)+2B(g)![]() 2C(g)+3D(g)。在温度和体积都相同的条件下分别建立两个平衡:①.A、B的起始物质的量为3mol和2mol,②.C、D的起始物质的量分别为4mol和6mol。四个选项中错误的是( )
2C(g)+3D(g)。在温度和体积都相同的条件下分别建立两个平衡:①.A、B的起始物质的量为3mol和2mol,②.C、D的起始物质的量分别为4mol和6mol。四个选项中错误的是( )
A. 达平衡时,①途径的反应速率vA不等于②途径的反应速率vA
B. ①、②都达到平衡时,体系内混合气体的平均相对摩尔质量相同
C. ①、②都达到平衡时,体系内混合气体的组成百分比相同
D. 达平衡时,①途径所得混合气的密度为②途径所得混合气密度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(s)+B(g) ==3C(g)+4D(g)反应中,表示该反应速率最快的是
A. υ(A)=1.5 mol·L1·s1B. υ(B)=0.5 mol·L1·s1
C. υ(C)=0.8 mol·L1·min1D. υ(D)=4mol·L1·min1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应化学平衡常数的表达式:K=_______________________________;
(2)该反应为________(填“吸热”或“放热”)反应;
(3)下列说法中能说明该反应达平衡状态的是__________
A、容器中压强不变
B、混合气体中c(CO)不变
C、混合气体的密度不变
D、c(CO) = c(CO2)
E、单位时间内生成CO的分子数与生成H2O的分子数相等
(4)某温度下,各物质的平衡浓度符合下式:c(CO2)×c(H2)=c(CO)×c(H2O),试判此时的温度为__________℃。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com