
| A. | c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-) | ||
| C. | c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | D. | c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
分析 NaHSO3是强碱弱酸酸式盐,HSO3-既能水解也能电离,但其电离程度大于水解程度,导致该溶液呈酸性,溶液中存在电荷守恒及物料守恒,根据电荷守恒及物料守恒判断.
解答 解:A.NaHSO3是强碱弱酸酸式盐,HSO3-既能水解也能电离,但其电离程度大于水解程度,导致该溶液呈酸性,因为HSO3-和水都电离出氢离子,所以溶液中离子浓度大小顺序是c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故A错误;
B.溶液中存在电荷守恒c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),故B错误;
C.溶液中存在电荷守恒c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),存在物料守恒c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),所以得c(H2SO3)+c(H+)=c(SO32-)+c(OH-),故C正确;
D.溶液中存在物料守恒c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故D错误;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,结合溶液中存在的守恒来分析解答,易错点是溶液中c(H+)、c(SO32-)相对大小的比较,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1s22s22p5 | B. | 1s22s22p43s2 | ||
| C. | 1s22s22p63s23p63d54s1 | D. | 1s22s22p63s23p63d34s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
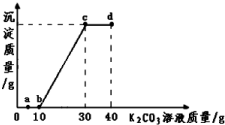
| A. | 向a点对应的溶液中滴加无色酚酞试液,溶液为无色 | |
| B. | 该温度下,K2CO3的溶解度为100g | |
| C. | 由图象可得,10g该溶液中氯化钙的质量约为8g | |
| D. | b、c、d三点对应的溶液中分别含有两种溶质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粘有油脂的试管可以用热的纯碱溶液洗涤 | |
| B. | 食醋中含有乙酸,乙酸可由乙醇氧化得到 | |
| C. | 煤的气化、液化只发生物理变化 | |
| D. | 天然气作为化工原料主要用于合成氨和合成甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气 二氧化碳 氢氧化钠 | B. | 氯化钠 过氧化钠 氯化铵 | ||
| C. | 氯化钠 过氧化氢 氯化铵 | D. | 氯化钠 氦气 氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L SO3中含有氧原子数目为3NA | |
| B. | 常温常压下,56g铁与足量硫粉反应,转移的电子数目为3NA | |
| C. | 标准状况下,22.4L Cl2溶于足量水中,转移的电子数目为NA | |
| D. | 标准状况下,22.4L NH3溶于水配成1L溶液,其浓度为1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com