
I��ú����Ȼ���Ĺ������̼�ͼ���£�
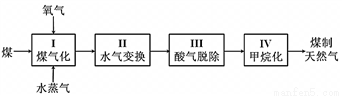
�ŷ�ӦI��C(s) + H2O(g) CO(g) + H2(g) ��H = +135 kJ��mol��1��ͨ����������벿��̼����ȼ�շ�Ӧ������������ת����ƽ���ƶ�ԭ��˵��ͨ�����������ã�___________________________��
CO(g) + H2(g) ��H = +135 kJ��mol��1��ͨ����������벿��̼����ȼ�շ�Ӧ������������ת����ƽ���ƶ�ԭ��˵��ͨ�����������ã�___________________________��
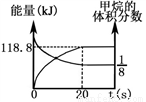
�Ʒ�ӦII��CO(g) + H2O(g)  CO2(g) + H2(g) ��H = ?41 kJ��mol��1����ͼ��ʾ��ͬ�¶������£�ú������ӦI������������ȣ�ˮ������CO���ʵ���֮�ȣ���COƽ��ת���ʵı仯��ϵ��
CO2(g) + H2(g) ��H = ?41 kJ��mol��1����ͼ��ʾ��ͬ�¶������£�ú������ӦI������������ȣ�ˮ������CO���ʵ���֮�ȣ���COƽ��ת���ʵı仯��ϵ��
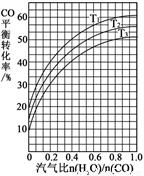
�� �ж�T1��T2��T3�Ĵ�С��ϵ��______________������С�����˳��
�� ��ú������ӦI�������������Ϊ0.8����ú������ӦI��ˮ���任��ӦII�õ�CO��H2�����ʵ���֮��Ϊ1:3����ӦIIӦѡ����¶���_______���T1����T2����T3������
�Ǣ� ���黯��ӦIV����֮ǰ��Ҫ�������ᷴӦIII��ú����ӦI��II��������к��������������壬�ֱ���H2S��_______��
�� ��ҵ�ϳ�����̼�����Һ�ѳ�H2S����õ�������ʽ�Σ��÷�Ӧ�����ӷ���ʽ��_______��
II�����ü��鳬������CO2�����ɵõ�����CO�����壬������Ͷ�����̼ת��Ϊ�����õĻ�ѧƷ������Դ�ͻ����ϵ�˫�������شü����еĻ�ѧ��ӦΪ��
CH4 (g)��3CO2 (g) 2H2O(g)��4CO(g)
2H2O(g)��4CO(g)  H>0
H>0
CH4��������CO2�Ĵ�ת��ԭ��ʾ����ͼ��
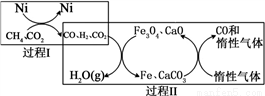
�ȹ���II��ʵ���˺��������뺬̼���ֵķ��롣����H2O(g)�Ļ�ѧ����ʽ��______________��
�ɼ������I����II�еĸ�����ת����ȫ������˵����ȷ����_______����(�����)
a������I����II�о�����������ԭ��Ӧ
b������II��ʹ�õĴ���ΪFe3O4 ��CaCO3
c��������IͶ�� ���ɵ��¹���II�д���ʧЧ
���ɵ��¹���II�д���ʧЧ
��6��һ�������£������Ϊ2L�ĺ����ܱ������г���1.2 mol CH4(g)��4.8 mol CO2(g)��������ӦCH4 (g)��3CO2 (g) 2H2O(g)��4CO(g)
2H2O(g)��4CO(g)  H>0��ʵ���ã���Ӧ���յ������ͼ�������������ʱ��仯������ͼ����ͼ������������£��˷�Ӧ��
H>0��ʵ���ã���Ӧ���յ������ͼ�������������ʱ��仯������ͼ����ͼ������������£��˷�Ӧ�� H=________________��
H=________________��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�걱���л�������һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ٸ���ƿ���ȱ���ʹ��ʯ����
����ȡ����ˮ��װ���¶ȼ�Ҫ������ȵ�ˮ��
�۷�ҺʱҪ����Һ©���Ͽڲ���������ʹ���ϰ��۶�©���ϵ�С��
����Һ©���е���Һʱ��Ҫһֻ�ְ�ס�ڲ�����һֻ����ס�������ֵߵ���
������ƿ�Ŀ̶����Ϸ���ˮ��δ����Ϳ�ʼ������Һ
��ʵ������ȡ����ʱ��Ϊ�˷�ֹ������Ⱦ���������������������������Һ����
A. �٢ڢ� B. �ۢܢ� C. �ڢݢ� D. �ۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ʡɳ��2016-2017ѧ��߶���ѧ�ڵ�����˫�ܿ���ѧ�Ծ���A���� ���ͣ������
X��Y��M��Z��RΪǰ������Ԫ�أ���ԭ��������������XY2�Ǻ���ɫ���壻X����Ԫ�ؿ��γ�XH3��M�����ڱ��е縺������Ԫ�أ�Z��̬ԭ�ӵ�M����K���������3����R2�����ӵ�3d�������9�����ӡ���ش��������⣺
��1����̬Yԭ�ӵļ۵����Ų�ͼ��______��Z���������е�һ��������������Ԫ����_______��Ԫ�����ƣ�
��2��XY2? ���ӵ����幹����________��R2����ˮ������[R��H2O��4]2+�У��ṩ�µ��ӶԵ�ԭ����________��Ԫ�ط��ţ���
��3����֪XH3����R2+�γ������ӣ���XM3������R2+�γ������ӣ���ԭ����_______________��
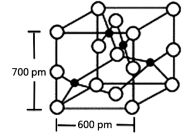
��4��Y��R���γɵĻ����ᄃ�徧����ͼ��ʾ,�þ���Ļ�ѧʽ:_____________������������ͼ��ʾ����þ����ܶ���___________g?cm-3����ʽ��������������С�������һλ����
��5��ͼ1��ʾij�ֺ����л�������Ľṹ���������4����ԭ�ӷֱ�λ�����������4�����㣨��ͼ2���������ڴ��ڿ�ǻ����Ƕ��ij���ӻ���Ӳ��γ�4���������ʶ�����з��ӻ������У��ܱ����л�������ʶ�����________�����ţ���
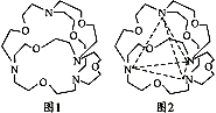
a��CF4 b��CH4 c��NH4+ d��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ʡɳ��2016-2017ѧ��߶���ѧ�ڵ�����˫�ܿ���ѧ�Ծ���A���� ���ͣ�ѡ����
�����ᡢ���ᡢ��������ᶼ��ǿ�ᣬ��������ˮ��Һ�в�����������ڱ������еĵ���
����������ӱ������ж�����˵���в���ȷ���ǣ�������
HClO4 | H2SO4 | HCl | HNO3 | |
Ka | 1.6��10��5 | 6.3��10��9 | 1.6��10��9 | 4.2��10��10 |
A. �ڱ������и�������������������ǿ����
B. �ڱ��������������ᶼû����ȫ����
C. �ڱ�����������ĵ��뷽��ʽΪH2SO4=2H++SO42��
D. ���ǿ�����䱾���Ľṹ���ܼ��������й�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ʡɳ��2016-2017ѧ��߶���ѧ�ڵ�����˫�ܿ���ѧ�Ծ���A���� ���ͣ�ѡ����
���и��������������ۻ�ʱ�����˷����������������ͬ�����͵��ǣ�������
A. �����������ʯ�ҵ��ۻ� B. ��ɱ������� C. �Ȼ��ƺ������ۻ� D. ʳ�κͱ����ۻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ���������С��������еȣ�������ѧ�ڵڶ����������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʽΪC4H8O����Ԫ��ͬ���칹�干�У������������칹��( )
A. 5�� B. 6�� C. 7�� D. 8��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���Ĵ�ʡ��������߶���ѧ����ĩ��⻯ѧ�Ծ��������棩 ���ͣ�ʵ����
����ij��ѧ��ȤС��Ҫ����к��ȵIJⶨ���ش��������⣺
��1��ʵ�����ϱ��д�С�����ձ�����ĭ���ϡ���ĭ���ϰ塢��ͷ�ιܡ����β����������0.5mol•L��1���ᡢ0.55mol•L��1NaOH��Һ��ʵ����ȱ�ٵIJ�����Ʒ��_______��
��2����֪����Ӧ����Һ�ı�����cΪ4.18J���橁1•g��1��0.5mol•L��1�����0.55mol��L��1NaOH��Һ���ܶȾ�Ϊ1g��cm��3��ʵ��ʱ��¼��ʵ���������£�
ʵ�� ���� | ��Ӧ�P���� | �� Һ �� �� | ||
t1 | t2 | |||
1 | 50mL0.55mol•L-1NaOH��Һ | 50mL.0.5mol•L-1HCl��Һ | 20�� | 23.3�� |
2 | 50mL0.55mol•L-1NaOH��Һ | 50mL.0.5mol•L-1HCl��Һ | 20�� | 23.5�� |
��������������Ʒ�Ӧ���к��ȡ�H1=____________��������λС����
����֪��CH3COOH(aq) CH3COO-(aq)+H+(aq) ��H2>0 ,
CH3COO-(aq)+H+(aq) ��H2>0 ,
CH3COOH(aq)+OH-(aq)= CH3COO-(aq)+H20(l) ��H3 ���H3_____��H1���>������<������=����
����ijʵ��С�����������ữ��KMnO4��H2C2O4��Ӧ��̽������������Ի�ѧ��Ӧ���ʵ�Ӱ�족����С��ʵ�鷽������(ʵ��ⶨKMnO4��Һ��ȫ��ɫʱ��)���ش��������⣺
ʵ�� ��� | H2C2O4��Һ | ����KMnO4��Һ | H2O/mL | �¶�/�� | KMnO4��Һ��ȫ��ɫʱ�䣨s�� | ||
Ũ��/mol��L-1 | ���/mL | Ũ��/mol��L-1 | ���/mL | ||||
�� | 0.20 | 2.0 | 0.010 | 4.0 | 2.0 | 25 | t1 |
�� | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
�� | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 50 | t3 |
��3��������Ӧ�����ӷ���ʽΪ______________________________________
��4��t1_____ t2���>������<������=��������������__________________
��5��ʵ��ں�ʵ�������ʵ���Ŀ����______________________________
��6����ͬѧ��ʵ��ʱ���֣������ữ��KMnO4��H2C2O4��Ӧ��ʼʱ����Һ��ɫ��������Ӧһ��ʱ�����Һ��ɫ���Լӿ졣�������ʵ������ͬѧ������в��룺
����٣������ữ��KMnO4��H2C2O4��Ӧ�Ƿ��ȷ�Ӧ��������Һ�¶����ߣ���Ӧ���ʼӿ졣
����ڣ�__________________�����㲹�䣩
Ҫ֤ʵ����ڣ��������ữ�ĸ��������Һ��������Һ�⣬����Ҫѡ����Լ���______��
A.����� B.������ C.ˮ D.�Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���Ĵ�ʡ��������߶���ѧ����ĩ��⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ����٤��������ֵ��������������ȷ����
A. ��16g��ԭ�ӵĶ������辧���к��еĦҼ���ĿΪ2NA
B. 1mol��(��CH3)����������Ϊ9NA
C. 12��ʯī�к��еĹ��ۼ���ĿΪ1.5NA
D. 2molSO2��1molO2��һ�������·�Ӧ���û���������������2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ʡ2016-2017ѧ���һ3���¿���ѧ�Ծ� ���ͣ������
����·�Ӧ�Ļ�ѧ��ףʽ�����ӷ���ʽ:
��1�������ɫ���Ļ�����д��ԣ���Ӧ_____________��
��2����ҵ���ƴֹ�ķ�Ӧ____________��
��3����������Һ�м��������ˮ�����ӷ���ʽ____________��
��4����ϡ������ϴͭ��������ϵ�ͭ������ӷ���ʽ��____________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com