
分析 (1)配制溶液操作步骤有计算、称量、溶解、冷却、转移、洗涤、定容、摇匀、装瓶等操作,据此选择仪器;
(2)根据n=cV计算NaOH的物质的量,再根据m=nM计算其质量;根据配制步骤判断玻璃棒的作用;
(3)根据冷却、转移、洗涤、定容、摇匀、装瓶,选择步骤正确的操作顺序;
(4)分析不当操作对溶液的体积,溶质的物质的量的影响,依据C=$\frac{n}{V}$进行误差分析;
(5)根据实验操作出现的错误应从新配制;
(6)强碱具有强烈的腐蚀性,需用水冲洗,再用酸中和.
解答 解:(1)配制250mL 1.00mol/LNaOH溶液操作步骤:首先计算出需要的药品的质量,然后用托盘天平称量,后放入烧杯中溶解,同时用玻璃棒搅拌,待溶液冷却至室温后,用玻璃杯引流移液至250mL容量瓶,然后洗涤烧杯和玻璃棒2至3次,将洗涤液也注入容量瓶,然后向容量瓶中注水,至液面离刻度线1-2cm时,改用胶头滴管逐滴加入,至凹液面与刻度线相切,然后摇匀、装瓶.用到的仪器有:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,故必须使用的仪器是:250mL容量瓶、胶头滴管、药匙,
故答案为:250mL容量瓶、胶头滴管、药匙;
(2)NaOH的摩尔质量=40g/mol,250mL 1.00mol/LNaOH溶液中n(NaOH)=0.25L×1mol/L=0.25mol,需NaOH固体质量为=0.25mol×40g/mol=10.0g,将称量好的NaOH固体放入烧杯中,然后用适量蒸馏水溶解,玻璃棒在该实验中所起的作用是搅拌,加速固体溶解,
故答案为:10.0g;搅拌,加速固体溶解;
(3)其余步骤为冷却、转移、洗涤、定容、摇匀、装瓶,所以正确的步骤为:BAEDC,
故答案为:BAEDC;
(4)NaOH固体溶解后未冷至室温立即进行定容,冷却后溶液体积偏小,溶液浓度偏大;
故答案为:偏高;
②定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高;
故答案为:偏高;
(5)实验操作出现加蒸馏水时不慎超过了刻度,则溶液的浓度偏小,应重新配制,
故答案为:重新配制;
(6)浓氢氧化钠溶液不慎溅到皮肤上,先用水冲洗,再涂上硼酸溶液,
故答案为:先用水冲洗,再涂上硼酸溶液.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制过程是解题关键,注意从c=$\frac{n}{V}$分析误差,侧重于常识性内容的考查,题目难度不大,注意基础知识的积累.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:实验题

 .B→C的反应条件为加热(或煅烧),C→Al的制备方法称为电解法.
.B→C的反应条件为加热(或煅烧),C→Al的制备方法称为电解法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 将乙烯通入酸性KMnO4溶液中 | 证明乙烯能发生加成反应 |
| B | 向含酚酞的NaOH溶液中加入氯水 | 证明Cl2具有漂白性 |
| C | 常温下,向Fe和Cu中分别加入稀盐酸 | 比较Fe和Cu的金属活动性 |
| D | 将两根铁钉分别放入甲乙两支试管中,甲为干燥的试管,乙中含有少量食盐水. | 证明有NaCl参加反应,腐蚀速率更快 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器编号 | 物质的起始浓度(mol•L-1) | 物质的平衡浓度(mol•L-1) | ||
| c(NO2) | c(NO) | c(O2) | c(O2) | |
| Ⅰ | 0.6 | 0 | 0 | 0.2 |
| Ⅱ | 0.3 | 0.5 | 0.2 | |
| Ⅲ | 0 | 0.5 | 0.35 | |
| A. | 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4:5 | |
| B. | 达平衡时,容器Ⅱ中 c(O2 )/c(NO2 ) 比容器Ⅰ中的大 | |
| C. | 达平衡时,容器Ⅲ中 NO 的体积分数小于50% | |
| D. | 当温度改变为 T2时,若 k正=k逆,则 T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

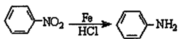 ,-NH2易被强氧化剂氧化
,-NH2易被强氧化剂氧化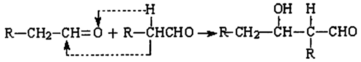
 .
. .
.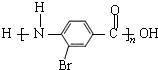 .
.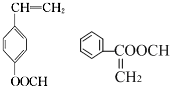 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
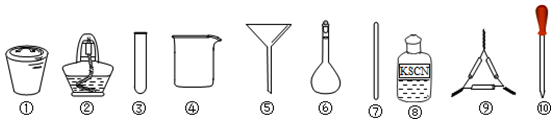
| A. | 将茶叶灼烧灰化,选用①、②、⑦和⑨ | |
| B. | 用浓硝酸溶解茶叶并加蒸馏水稀释,选用③和⑩ | |
| C. | 过滤得到滤液,选用④、⑤和⑦ | |
| D. | 检验中滤液中的Fe3+,选用③、⑧和⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 邻甲基苯甲酸( 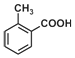 )含有苯环且属于酯类的同分异构体有5种 )含有苯环且属于酯类的同分异构体有5种 | |
| B. | CH3-CH=CH-CH2-CH3中最多有9个原子在同一平面上 | |
| C. | 有机物 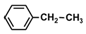 在一定条件下与足量H2加成,所得产物的一氯代物有5种 在一定条件下与足量H2加成,所得产物的一氯代物有5种 | |
| D. | 可以用裂化汽油萃取溴水中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
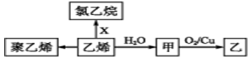
| A. | 甲与CH3OCH3互为同分异构体 | B. | X为Cl2 | ||
| C. | 聚乙烯是纯净物 | D. | 甲→乙反应类型为取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
| A. | 达到平衡时,反应Ⅰ、Ⅱ对比,平衡常数:K(Ⅰ)>K(Ⅱ) | |
| B. | 对于反应Ⅰ,前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1 | |
| C. | 对于反应Ⅰ,若30min时只改变温度为T2℃,再次达到平衡时H2的物质的量为3.2mol,则T1>T2 | |
| D. | 对于反应Ⅰ,若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡正向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com