
| A. | FeO | B. | Fe2O3 | C. | Fe3O4 | D. | 无法确定 |
分析 把铝粉和某铁氧化物粉末分成两等份,一份在高温下恰好完全反应生成铁与氧化铝,Fe与盐酸反应生成FeCl2与H2,另一份直接加入足量的NaOH溶液分反应生成偏铝酸钠与氢气,前后两种情况下生成的气体质量比是4:3,设氢气物质的量分别为4mol、3mol,根据电子转移守恒计算n(Fe)、n(Al),再根据Fe元素总物质的量及电子转移守恒列方程计算.
解答 解:设铁的氧化物是FexOy,每一份铁的氧化物是1mol,则反应产生金属铁的物质的量是xmol,若金属铝是amol,根据电子守恒得到3a=2y,根据方程式得到:$\frac{3a}{2}$:x=4:3,解得x=$\frac{9a}{8}$,所以x:y=3:4,所以是四氧化三铁,
故选C.
点评 本题考查混合物的计算,难度中等,清楚反应过程是关键,注意混合物的计算中守恒的运用,注意运用赋值法简化计算.


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
 向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )
向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )| A. | M-N间一定存在c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | M点对应的盐酸体积为10.0mL | |
| C. | pH=7溶液中有c(NH4+)=c(Cl-)=c(H+)=c(OH-) | |
| D. | P点处的溶液中存在:2c(NH4+)+2c(NH3•H2O)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
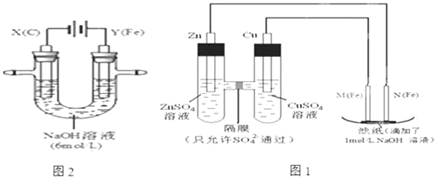
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2 Mn2O7=4Na2MnO4+O2 | B. | Na2O2+2NO2=2NaNO2+O2 | ||
| C. | 2Na2O2+2N2O3=4NaNO2+O2 | D. | 2Na2O2+2N2O4=4NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
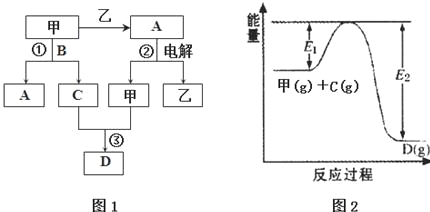
| 容器编号 | n(甲) | n(C) | n (D) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com