
【题目】0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量。
(1)写出反应的热化学方程式。
(2)已知H2O(l)转化为H2O(g)的△H=44kJ·mol-1,试计算11.2L(标准状况)气态乙硼烷完全燃烧生成气态水时放出的热量。
【答案】B2H6(g)+3O2(g)====B2O3(s)+3H2O(l) ΔH="-2" 165 kJ·mol-11 016.5
【解析】
试题(1)0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165KJ的热量,反应的热化学方程式为B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H=-2165kJ/mol。
(2)①B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol,
②H2O(l)═H2O(g)△H=+44kJ/moL,
由盖斯定律可知①+②![]() 3得:B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2033kJ/mol,
3得:B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2033kJ/mol,
11.2L(标准状况)即0.5mol乙硼烷完全燃烧生成气态水时放出的热量2033kJ×0.5=1016.5kJ,


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】生产生活中的许多现象或应用都与化学知识有关。下列现象或应用与胶体性质无关的是
A. 将盐卤或石膏加入豆浆,制成豆腐。
B. 一支钢笔使用两种不同型号的蓝黑墨水,易出现堵塞。
C. 泡沫灭火器中将Al2(SO4)3与NaHCO3两溶液混合后,喷出大量泡沫,起到灭火作用。
D. 清晨,人们经常能看到阳光穿过茂密的树木枝叶所产生的美丽景象。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH相等、体积相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌全部溶解且放出气体一样多,则下列说法正确的是
A.反应开始时的速率:甲=乙
B.反应所需时间:甲<乙
C.反应开始时,酸的物质的量浓度:甲=乙
D.反应结束时,溶液pH:甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真观察下列装置,回答下列问题:
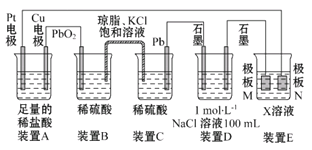
(1)装置B中PbO2上发生的电极反应为____________________________。
(2)装置A中总反应的离子方程式为______________________________。
(3)若装置E的目的是在铜上镀银,则X为____,极板N的材料为____。
(4)当装置A中Cu电极质量改变6.4 g时,装置D中产生的气体体积为____(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知25℃:
H2S | 一元酸HA |
Ka1=9.1×10—8,Ka2=1.1×10—12, | Ka=9.1×10—10 |
写出H2S与钾盐KA溶液 ( A-表示酸根 ) 反应的化学方程式:______________________。
(2)次磷酸(H3PO2)是一种化工产品,具有较强的还原性。
①H3PO2是一元弱酸,写出其电离方程式____________________ 。
②H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。NaH2PO2为________(填 “正盐”或“酸式盐”),其溶液显______(填“弱酸性”、“中性”或“弱碱性”)。利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为_______(填化学式)。
(3)向NH4Al(SO4)2溶液中滴加1molL—1NaOH溶液,沉淀的物质的量随加入NaOH溶液体积的变化如图所示。(滴加过程无气体放出)
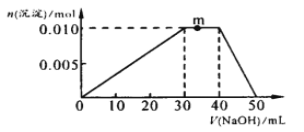
①写出m点发生反应的离子方程式_____________________________________。
②往NH4Al(SO4)2溶液中改加20mL1.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_____________mol 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压下,向密闭容器中充入4molSO2和2molO2,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ,则下列分析正确的是( )
2SO3(g) ΔH<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ,则下列分析正确的是( )
A. 在该条件下,反应前后的压强之比为6∶5.3
B. 若反应开始时容器容积为2L,则v(SO3)=0.35mol·L-1·min-1
C. 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)>1.4mol
D. 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量小于QkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列装置属于原电池的是________。
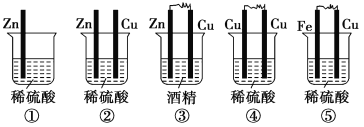
(2)在选出的原电池中,________是负极,发生________反应,________是正极,该极的现象是______________________________。
(3)此原电池反应的化学方程式为_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com