
某温度下,在一容积不变的密闭容器中,反应A(g) + 2B (g)  3C(g)达平衡时,A、B、C的物质的 量分别为3 mol,2 mol和4 mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向是( )
3C(g)达平衡时,A、B、C的物质的 量分别为3 mol,2 mol和4 mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向是( )
A.向左移动 B.向右移动 C.不移动 D.无法判断
科目:高中化学 来源: 题型:
化学实验有助于理解化学知识,形成化学观念。在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
(1)下列收集Cl2的正确装置是________。

(2)将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是____________________。
(3)设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,_________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物的说法正确的是( )
A.聚乙烯可发生加成反应
B.石油干馏可得到汽油、煤油等
C.顺2丁烯和反2丁烯的加氢产物相同
D.石油的裂解是为了提高轻质燃料的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家最近研究出一种环保,安全的储氢方法,其原理可表示为:
下列有关说法不正确的是( )
A.储氢、释氢过程均有能量变化
B.NaHCO3、HCOONa均含有离子键和共价键
C.储氢过程中,NaHCO3被还原
D.释氢过程中,每消耗0.1mol H2O放出2.24L的H2
查看答案和解析>>
科目:高中化学 来源: 题型:
把4mol A和2.5mol B混合于2L密闭容器中,发生反应:3A(g)+2B(s)  xC(g)+D(g) 5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol•L-1•min-1 ,下列结论错误的是( )
xC(g)+D(g) 5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol•L-1•min-1 ,下列结论错误的是( )
A.A的平均反应速率为0.15 mol•L-1•min-1 B.平衡时,C的浓度为0.25mol•L-1
C.B的平均反应速率为0.1 mol•L-1•min-1 D.平衡时,容器内压强为原来的0.875倍
查看答案和解析>>
科目:高中化学 来源: 题型:
氨气是氮循环中的重要物质,在人类的生产和
 生活中有着广泛的应用。
生活中有着广泛的应用。
(1)右图是N2与H2反应过程中能量变化的示意图,
则该反应生成液态氨的热化学方程式是:
(2)已知:①H2O(g)===H2O(l) ΔH=-Q1 kJ·mol-1
②C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-Q2 kJ·mol-1
③C2H5OH(g)===C2H5OH(l) ΔH=-Q3 kJ·mol-1
则23 g液体酒精完全燃烧生成CO2(g)和H2O(l),释放出的热量为 kJ(请用Q1、Q2、Q3来表示 )
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A.使酚酞变红色的溶液:Na+、Ba2+、I-、Cl-
B.使甲基橙变红色的溶液:Fe2+、K+、NO3-、SO42-
C.含有0.1 mol·L-1 Fe3+的溶液:Na+、K+、SCN-、NO
D.由水电离产生的c(H+)=10-12mol·L-1的溶液:NH4+、SO42-、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g) △H 1 = +489.0 kJ·mol-1
C(石墨) +CO2(g) = 2CO(g) △H 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 ▲ 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= ▲ 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图10所示,则该反应的ΔH ▲ 0(填“>”、“<”或“=”)。


图10 图11
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图11所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ ▲ KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 ▲ 。当氨碳比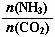 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为
▲ 。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有 X和
X和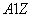 X+两种粒子,下列叙述正确的是
X+两种粒子,下列叙述正确的是
A.一定都是由质子、中子、电子组成的
B.化学性质几乎完全相同
C.质子数一定相等,质量数和中子数一定不相等
D.核电荷数和核外电子数一定相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com