
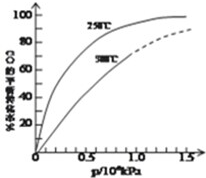
 在容积可变的密闭容器中,由CO和H2合成甲醇CO(g)+2H2(g)═CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示.
在容积可变的密闭容器中,由CO和H2合成甲醇CO(g)+2H2(g)═CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示.| 生成物浓度的幂次方乘积 |
| 反应物浓度的幂次方乘积 |
| [CH3OH] |
| [CO]?[H2]2 |
| [CH3OH] |
| [CO]?[H2]2 |
 ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
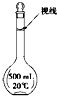 实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有酸中,二氧化硅只与氢氟酸反应,可用石英制造耐酸容器 |
| B、工业上金属Mg、Al都是用电解其熔融的氯化物制得的 |
| C、二氧化氯具有氧化性,可用于自来水的杀菌消毒 |
| D、若铁制品表面的钢镀层有破损,会加快铁制品腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
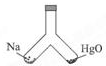 如图所示,在密闭容器中,一边装有一定量的金属钠,一边装有一定量的氧化汞,同时加热容器的两部分,钠和氧化汞都完全反应后,恢复到原温度,容器内空气的成分仍不变.则钠和氧化汞的物质的量之比是( )
如图所示,在密闭容器中,一边装有一定量的金属钠,一边装有一定量的氧化汞,同时加热容器的两部分,钠和氧化汞都完全反应后,恢复到原温度,容器内空气的成分仍不变.则钠和氧化汞的物质的量之比是( )| A、1:1 |
| B、2:1 |
| C、23:216.6 |
| D、216.6:23 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 稀硫酸 |
| 氧化铜 |
| 稀硫酸 |
| 铁 |
| A、相等 | B、①多 |
| C、②多 | D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2和SO2的漂白原理不同,混合使用效果更好 |
| B、常温下,向饱和的Na2CO3溶液中通入大量的CO2气体,结果有晶体析出 |
| C、用铂丝蘸取某溶液在酒精灯火焰上灼烧,透过蓝色钻玻璃观察到火焰颜色为紫色,说明原溶液中不含Na+ |
| D、FeCl2和Fe(OH)3都不能通过化合反应直接制取 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在电热水器的钢铁内胆中装入铜棒可以防止内胆被腐蚀 |
| B、二氧化硅具有半导体性能,可以制成光电池 |
| C、二氧化氯(ClO2)和臭氧可用作自来水消毒剂 |
| D、油脂水解可得到氨基酸和甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com