
����Ŀ����֪��Ӧ:2NO2(g) ![]() N2O4(g)�Ƿ��ȷ�Ӧ,Ϊ��̽���¶ȶԻ�ѧƽ���Ӱ��,������������ʵ��:��NO2��N2O4�Ļ������ͨ��ס���������ͨ����ƿ��,Ȼ���ü��Ӽ�ס��Ƥ��,������ƿ�ֱ���������ֱ�ʢ��500 mL 6 mol��L-1��HCl��Һ��ʢ��500 mL����ˮ���ձ���(���ձ�����Һ���¶���ͬ)��
N2O4(g)�Ƿ��ȷ�Ӧ,Ϊ��̽���¶ȶԻ�ѧƽ���Ӱ��,������������ʵ��:��NO2��N2O4�Ļ������ͨ��ס���������ͨ����ƿ��,Ȼ���ü��Ӽ�ס��Ƥ��,������ƿ�ֱ���������ֱ�ʢ��500 mL 6 mol��L-1��HCl��Һ��ʢ��500 mL����ˮ���ձ���(���ձ�����Һ���¶���ͬ)��
��1����ʵ����������������ͨ����ƿ,�������ͼ��__________��
��2�����ձ�����Һ�з���125g NaOH����,ͬʱ���ձ����з���125g����茶���,����ʹ֮�ܽ⡣����ƿ���������ɫ��__________ԭ����__________����ƿ���������ɫ��__________,ԭ����__________��
��3����ʵ�����ó��Ľ�����__________��
��4��ijͬѧ��Ϊ��ʵ�����Ʋ�����ȫ��ѧ,��ָ����ʱӰ�컯ѧƽ������ز�ֹһ��,����Ϊ����ָ����һ��������__________��
���𰸡�ʹ������ƿ����ʼ״̬��ȫ��ͬ���������� ���� NaOH�ܽ���ȣ��к�HClҲ���ȣ�ʹ��ƿ�����¶����ߣ�ƽ�������ƶ���c��NO2������ ��dz NH4NO3�ܽ����ȣ�����ƿ������¶Ƚ��ͣ�ƽ��������N2O4�����ƶ���ʹNO2��Ũ�ȼ�С�� ����ƽ�������ȷ����ƶ�������ƽ������ȷ����ƶ� ѹǿ
��������
��1����������������������ͨ����ƿ������ʹ������ƿ����ʼ״̬��ȫ��ͬ���������ã���2�������¶ȶԻ�ѧƽ���Ӱ����������������ܽ�����ᷢ���кͷ�Ӧ����ʹ��Һ�¶����ߣ�������ܽ�ʹ��Һ�¶Ƚ��ͣ���2NO2��g��N2O4��g����H��0�����ݻ�ѧƽ���ƶ�ԭ������������ƽ�������ȷ�����У�����ƽ������ȷ�Ӧ������У����������Ǻ���ɫ���壬��������������ɫ���壻��3�������¶ȶԿ��淴Ӧ��Ӱ����з�������4���÷�Ӧ����������룬�¶ȸı���������Ҳ�ı䣬ѹǿҲ��Ӱ�컯ѧƽ�⣮
��1����ʵ����������������ͨ����ƿ,�������ͼ�ǿ���ʹ������ƿ����ʼ״̬��ȫ��ͬ���������ã��ʴ�Ϊ��ʹ������ƿ����ʼ״̬��ȫ��ͬ������������
��2����NaOH����ˮ�Լ���NaOH��HCl�ķ�Ӧ����ʹ��Һ�¶����ߣ������ձ�������Һ���¶����ߣ��¶����ߣ�ƽ��2NO2��g��N2O4��g����H��0�����ȷ����ƶ��������淴Ӧ�����ƶ���NO2Ũ��������ɫ�����NH4NO3����ˮ�����ȵģ�ʹ��ϵ�¶Ƚ��ͣ�2NO2��g��N2O4��g����H��0����ȷ����ƶ�����������Ӧ�����ƶ���NO2Ũ�ȼ�С����ɫ��dz���ʴ�Ϊ�����NaOH�ܽ���ȣ��к�HClҲ���ȣ�ʹ��ƿ�����¶����ߣ�ƽ�������ƶ���c��NO2������dz��NH4NO3�ܽ����ȣ�����ƿ������¶Ƚ��ͣ�ƽ��������N2O4�����ƶ���ʹNO2��Ũ�ȼ�С��
��3������ʵ�������֪���ı��¶Ⱥ�ѧƽ�ⷢ���ƶ�������ƽ�������ȷ����ƶ�������ƽ������ȷ����ƶ����ʴ�Ϊ������ƽ�������ȷ����ƶ�������ƽ������ȷ����ƶ���
��4���÷�Ӧ�У��ı��¶Ⱥ������������ѹǿҲ��ı䣬��ѹǿ�Ըÿ��淴Ӧͬ�������Ӱ�죬���Ը�ʵ����Ʋ�����ȫ��ѧ���ʴ�Ϊ��ѹǿ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L�ܱ������У�����3A(g)��B(g) ![]() 2C(g)�ķ�Ӧ�����������A��B����4mol�� A��ƽ����Ӧ����Ϊ0.12mol��L��1��s��1����10s��������B�����ʵ�����
2C(g)�ķ�Ӧ�����������A��B����4mol�� A��ƽ����Ӧ����Ϊ0.12mol��L��1��s��1����10s��������B�����ʵ�����
A. 1.6 mol B. 2.8 mol C. 3.2 mol D. 3.6 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ������������ԭ��Ӧ����
A. 2KMnO4 +16HCl =2MnCl2 +5Cl2��+8H2O
B. Fe + 2HCl = FeCl2 + H2��
C. CaCO3 + 2HCl = CaCl2 + CO2�� + H2O
D. 2KClO3 + H2C2O4 + H2SO4 ![]() 2ClO2��+ K2SO4 + 2CO2�� + 2H2O
2ClO2��+ K2SO4 + 2CO2�� + 2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ȤС���ijƷ��������Ħ�����ɷּ��京����������̽��:
�������:������Ħ������̼��ơ�����������ɣ������������ɷ���������ʱ������������
I.Ħ���������������Ķ��Լ���ȡ����������Ʒ����ˮ��ֽ��衢���ˡ�
��1���������м������NaOH��Һ�����ˡ�����������NaOH��Һ��Ӧ�����ӷ���ʽ��_____________________________________________________________��
��2������1��������Һ����ͨ�����������̼���ټ������ϡ���ᡣ�۲쵽��������__________________________________________________________________��
II.������Ʒ��̼��ƵĶ����ⶨ
������ͼ��ʾװ��(ͼ�мг�������ȥ)����ʵ�飬��ַ�Ӧ�ⶨC�����ɵ�BaCO3������������ȷ��̼��Ƶ�����������

����ʵ����̻ش���������:
��3��ʵ����������������ͨ������������ó��˿ɽ���B��C�еķ�Ӧ���⣬����:_________________________________________________��
��4��Dװ�õ�������____________________________________________��
��5��C�з�Ӧ����BaCO3�Ļ�ѧ����ʽ��_________________________________________��
��6�����и����ʩ�У�������߲ⶨȷ�ȵ���________(����)��
���ڼ�������֮ǰ��Ӧ�ž�װ���ڵ�CO2����
�ڵμ�����˹���
����A-B֮������ʢ��Ũ�����ϴ��װ��
����B-C֮������ʢ�б���̼��������Һ��ϴ��װ��
��7��ʵ����ȷ��ȡ8.00g��Ʒ���ݣ��������βⶨ�����BaCO3ƽ������Ϊ3.94g������Ʒ��̼��Ƶ���������Ϊ____________��
��8��������Ϊ���زⶨC�����ɵ�BaCO3������ֻҪ�ⶨװ��C������CO2ǰ��������һ������ȷ��̼��Ƶ�����������ʵ��֤�����˷����ⶨ�Ľ������ƫ�ߣ�ԭ����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���κ��¶��¾����Է����е���
A. 2N2(g)��O2(g)===2N2O(g) ��H����163 kJ��mol��1
B. Ag(s)��Cl2(g)===AgCl(s) ��H����127 kJ��mol��1
C. HgO(s)===Hg(l)��O2(g) ��H����91 kJ��mol��1
D. H2O2(l)===O2(g)��H2O(l) ��H����98 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2 L���ܱ������ڣ�800��ʱ��Ӧ2NO(g)��O2(g)![]()
![]()
![]() 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ��K��_____________________����֪��K300����K350������÷�Ӧ��______�ȷ�Ӧ��
��2����ͼ��ʾNO2�ı仯��������_______����O2��ʾ��0��2 s�ڸ÷�Ӧ��ƽ������v��_______________��

��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����________��
a��v(NO2)��2v(O2) b��������ѹǿ���ֲ���
c��v��(NO)��2v��(O2) d���������ܶȱ��ֲ���
��4��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����________��
a����ʱ�����NO2���� b���ʵ������¶� c������O2��Ũ�� d��ѡ���Ч����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£���5.6LCO2ͨ��������Na2O2��ַ�Ӧ���������ɵ�̼���Ƶ�����____�����������ʵ���________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������G��һ�־��п�űҩ�����Ե�������������ϳ�·������ͼ���£�

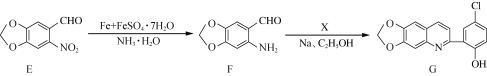
��֪��
(1) F�еĺ�������������Ϊ________��________��
(2) B��C�ķ�Ӧ����Ϊ________��
(3)�����廯����X�ķ���ʽΪC8H7ClO2��д��X�Ľṹ��ʽ��___________________________��
(4)д��ͬʱ��������������C��һ��ͬ���칹��Ľṹ��ʽ��__________________________��
�ٷ����к��б���������FeCl3��Һ������ɫ��Ӧ�����ܷ���������Ӧ��
�ڼ�������ˮ���������ֲ���ữ������о�ֻ��2�ֲ�ͬ��ѧ�������⡣
(5)д���� Ϊԭ���Ʊ�
Ϊԭ���Ʊ�![]() �ĺϳ�·������ͼ(���Լ����Ҵ����ã��ϳ�·������ͼʾ�����������)_________________________��
�ĺϳ�·������ͼ(���Լ����Ҵ����ã��ϳ�·������ͼʾ�����������)_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����20mL 0.10 mol/LCH3COOH��Һ��20mL 0.10 mol/LHX��Һ�ֱ���20mL 0.10 mol/LNaHCO3��Һ��ϣ���ò�������������V����ʱ�䣨t���仯����ͼ������˵��������ȷ����
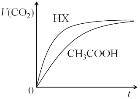
A. ��Ӧ��ʼǰ��HX��Һ��c(H+)����CH3COOH��c(H+)
B. CH3COOH��Һ��Ӧ������c(Na+)>c(CH3COO��)
C. ��Ӧ��������������Һ�У�c(CH3COO��)��c(X��)
D. �ɸ�ʵ���֪HXΪǿ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com