
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:解答题

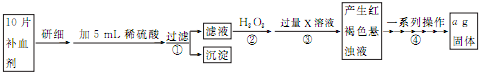

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol•L-1 | B. | 1.6mol•L-1 | C. | 0.8mol•L-1 | D. | 0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氢气作为一种清洁能源,必须解决它的储存问题,C60(结构见图)可用作储氢材料,已知C60中每个碳原子均达到8电子稳定结构.
氢气作为一种清洁能源,必须解决它的储存问题,C60(结构见图)可用作储氢材料,已知C60中每个碳原子均达到8电子稳定结构.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | C、D的物质的量的比值 | D. | 气体的总物质的量 | ||
| E. | 气体的平均摩尔质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com