
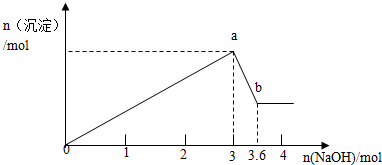
分析 Oa发生的反应为:Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓,ab段反应为:Al(OH)3+OH-═AlO2-+2H2O,结合图中消耗的NaOH的物质的量来计算生成沉淀的物质的量.
解答 解:设n(Al3+)=n(Al(OH)3)=x,
由Al(OH)3+OH-═AlO2-+2H2O
1 1
x (3.6-3)mol
则:x=(3.6-3)mol=0.6mol,
即生成氢氧化铝沉淀的物质的量为0.6mol;
设n(Fe3+)=y,根据反应Al3++3OH-═Al(OH)3↓可知生成0.6mol氢氧化铝消耗氢氧化钠的物质的量为:0.6mol×3=1.8mol,
Fe3++3OH-═Fe(OH)3↓
1 3
y (3-1.8)mol,
则:$\frac{1}{y}$=$\frac{3}{(3-1.8)mol}$
解得:y=0.4mol,
即:生成氢氧化铁沉淀的物质的量为0.4mol,
答:加入氢氧化钠溶液生成0.6mol氢氧化铝、0.4mol氢氧化铁.
点评 本题考查金属及化合物的性质、混合物反应的计算,题目难度中等,明确发生的化学反应与图象的对应关系是解答本题的关键,试题培养了学生的分析能力及化学计算能力.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 实验室中用铜片与稀HNO3反应制备NO2 | |
| B. | 常温下可以用铝制容器来盛装浓HNO3 | |
| C. | 实验室中用浓H2SO4干燥NH3 | |
| D. | 加热时,浓H2SO4不能将木炭氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
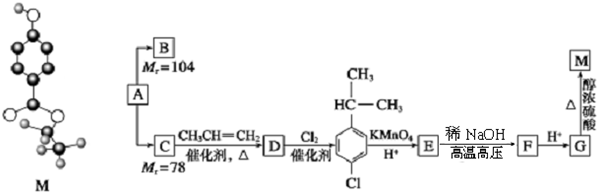

 ,B与等物质的量Br2作用时可能有2种产物.
,B与等物质的量Br2作用时可能有2种产物. .
.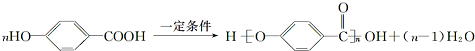 .
.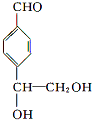 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
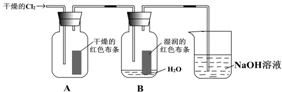 某同学设计了有关氯气的实验:
某同学设计了有关氯气的实验:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaC03是难溶于水的强电解质,在医学上用作钡餐 | |
| B. | 常用电解熔融氯化铝和冰晶石的混合物方法冶炼铝 | |
| C. | 明矾净水,硫酸铜溶液作农药,都与金属离子的水解有关 | |
| D. | 锅炉水垢中含有的CaSO4,可先用饱和碳酸钠溶液处理,而后用盐酸除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,向小试管中加入约3毫升饱和CuSO4溶液,再用胶头滴管沿试管壁小心地缓慢滴入 2 毫升浓H2SO4,静止片刻,请将观察到的现象填在空白处:
如图所示,向小试管中加入约3毫升饱和CuSO4溶液,再用胶头滴管沿试管壁小心地缓慢滴入 2 毫升浓H2SO4,静止片刻,请将观察到的现象填在空白处:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物都是由不同元素组成的,不同元素组成的物质一定是化合物 | |
| B. | 金属镁排在金属活动性顺序表中氢元素的前面,所以镁与酸反应一定放出氢气 | |
| C. | 中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应 | |
| D. | 氧化还原反应有元素化合价变化,有元素化合价变化的反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com