
一定条件下反应2AB(g)A2(g)+B2(g)达到平衡状态的标志是( )
A.单位时间内生成n mol A2,同时消耗2n mol AB
B.容器内三种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
可逆反应:2NO2(g)  2NO(g)+ O2(g) 在体积不变的密闭容器中进行,达到平衡状态的标志是( )
2NO(g)+ O2(g) 在体积不变的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
A. ①④ B.②③⑤ C.①③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)
ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)
ΔH=-1160 kJ·mol-1
下列说法不正确的是( )
A.由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH=-Q,Q>574 kJ·mol-1
B.等物质的量的甲烷分别参加反应①、②,反应转移的电子数不同
C.若用标准状况下4.48 L CH4还原NO2至N2则放出的热量为173.4 kJ
D.若用标准状况下4.48 L CH4还原NO2至N2,则整个过程中转移的电子总物质的量为1.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
将2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:2A(g)+3B(g)2C(g)+zD(g),若2分钟后达到平衡,A的转化率为50%,测得v(D)=0.25 mol/(L·min),则下列推断正确的是( )
A.v(C)=0.2 mol/(L·min)
B.z=3
C.B的转化率为25%
D.C的体积分数约为28.6%
查看答案和解析>>
科目:高中化学 来源: 题型:
温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法正确的是( )
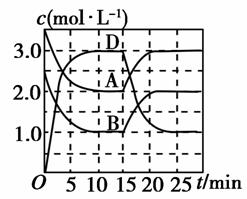
A.反应在前10 min的平均反应速率v(B)=0.1 mol·L-1·min-1
B.该反应的平衡常数表达式K=
C.若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动
D.反应至15 min时,改变的条件是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
某可逆反应X(g)+Y(g)Z(g)+2W(g),其化学平衡常数K和温度的关系如下表:
| T/℃ | 700 | 800 | 850 | 1000 |
| K | 0.01 | 0.05 | 0.10 | 0.40 |
(1)上述反应的平衡常数表达式K=________,ΔH________0(填“>”或“<”)。加入催化剂,该反应的ΔH将________(填“增大”、“减小”或“不变”)。
(2)若上述反应在绝热恒容的密闭容器内进行,则能说明该反应达到化学平衡状态的依据有________。
A.混合气体的密度保持不变
B.v正(X)=v正(Z)
C.容器内温度恒定
D.W的质量分数不变
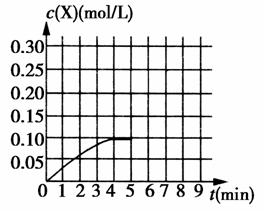
(3)在850 ℃、体积为1 L的密闭容器内,加入0.2 mol Z和0.3 mol W发生上述反应。X的c(X)-t曲线如图所示。
①0~4 min内W的平均速率为________mol·L-1·min-1。
②在5 min末将容器体积缩小至0.5 L,若在8 min末达到新平衡(此时X的浓度约为0.26 mol/L),请在图中画出5 min~9 min的X浓度的变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮的氧化物(用NOx表示)是大气污染物,必须进行处理。
(1)汽车尾气主要含有CO2、CO、SO2、NOx等物质,这种尾气逐渐成为城市空气污染的主要来源之一。
①汽车尾气中的CO来自于____________________,NO来自于_____________________。汽车尾气对环境的危害主要有________________________(至少填两种)。
②汽车尾气中的CO、NOx在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。反应的化学方程式可表示为__________________________。
(2)用氨可将氮氧化物转化为无毒气体。已知:4NH3+6NO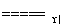 5N2+6H2O,8NH3+6NO2
5N2+6H2O,8NH3+6NO2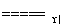 7N2+12H2O。同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气体完全转化为N2,则原混合气体中NO和NO2的体积之比是________。
7N2+12H2O。同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气体完全转化为N2,则原混合气体中NO和NO2的体积之比是________。
(3)工业尾气中氮的氧化物常采用碱液吸收法处理,若NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后得到一种钠盐,该钠盐的化学式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知离子反应:Fe3++3SCN-===Fe(SCN)3,具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
①取10 mL 1 mol/L FeCl3溶液,滴加3~4滴浓KSCN溶液,振荡后溶液立即变成血红色。
②取少量血红色溶液,滴加少许浓硝酸,静置,溶液变为无色,同时产生大量的红棕色气体混合物A。
③将该气体混合物A通入过量的Ba(OH)2溶液中,产生白色沉淀B和剩余气体C。气体C无色无味,能使燃烧的木条熄灭,可排放到空气中,不会改变空气的成分。
④过滤,向白色沉淀B中滴加少量稀硝酸,沉淀完全溶解,同时产生能使澄清石灰水变浑浊的无色无味气体D。
⑤取②中无色溶液少许,滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀E。
根据上述实验现象,回答下列问题:
(1)B的化学式为________________;E的化学式为__________。
(2)混合气体A的成分是________________(填化学式)。
(3)兴趣小组同学根据以上实验现象分析得出结论:Fe(SCN)3具有还原性,反应②中被氧化的元素是________________(填元素符号)。
(4)实验②中,还原剂与氧化剂的物质的量之比为_________。
(5)小组同学从上述实验中得到启发,若用SCN-间接检验Fe2+时应注意________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com