


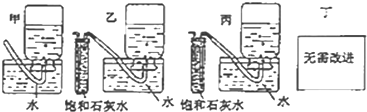
分析 (1)实验室用碳酸钙和稀盐酸反应制备二氧化碳,反应无需加热,且反应需要较多二氧化碳,应用②装置制备;实验中要依次进行除杂、干燥收集等操作;
(2)二氧化碳和澄清石灰水反应生成碳酸钙白色沉淀;
(3)根据过氧化钠的质量可以生成氧气的体积,理论生成气体的体积-实际氧气的体积=差值;
(4)根据是否能产生倒吸现象判断是否合理、安全;根据实验密度选择装置.
解答 解:(1)该反应的药品是固体和液体,且不需加热,所以所需装置为固液混合不加热型,所以排除①;③中只能制取少量二氧化碳而不能制取大量二氧化碳,所以排除③,故选②;
大理石和盐酸的反应是放热反应,盐酸具有挥发性,所以制取的二氧化碳中含有氯化氢气体、水蒸气,氯化氢和碳酸氢钠能反应生成二氧化碳,所以B装置的作用是吸收A装置中产生的盐酸酸雾,除去HCl气体;
二氧化碳和碳酸氢钠不反应,水蒸气能使无水硫酸铜由白色变蓝色,所以C装置内可能出现的现象是白色固体变蓝色;
过氧化钠和二氧化碳反应生成氧气,氧气能使带火星的木条复燃,检验时,可用带火星的木条放在管口,木条复燃说明收集到的气体为氧气,
故答案为:②;吸收A装置中产生的盐酸酸雾;白色固体变蓝色;带火星;复燃;
(2)二氧化碳能使澄清的石灰水变浑浊,若E中石灰水出现轻微白色浑浊,说明未反应的二氧化碳与石灰水反应所致,
故答案为:未反应的二氧化碳与石灰水反应所致;
(3)1.95g过氧化钠完全反应生成氧气的体积为v.
2Na2O2~~~~O2;
2mol 22.4L
$\frac{1.95g}{78g/mol}$ V
V=0.28L=280mL>250mL,所以实际收集到的氧气体积比理论计算值小,280mL-250mL=30mL;
原因是Na2O2可能含有其它杂质;D装置可能有氧气未被排出,
故答案为:偏小;30;Na2O2可能含有其它杂质,D装置可能有氧气未被排出;
(4)E装置容易产生倒吸现象,所以不安全、不合理,所以需要改进;饱和石灰水能和二氧化碳反应,所以饱和石灰水的作用是吸收二氧化碳,收集较纯净的氧气,乙试管中进气管较长,二氧化碳能充分和饱和石灰水反应,丙试管中进气管较短,导致二氧化碳和饱和石灰水反应不充分,且随着气体的进入,试管中的液体被排到水槽中,故选乙.
故答案为:不安全,不合理;乙.
点评 本题以钠的化合物为载体综合考查学生的分析能力和实验能力,为高频考点,注意把握实验的原理和注意事项,结合物质的性质把握实验,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | NaBr的电子式: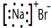 | B. | Na218O 中阴离子的结构示意图: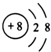 | ||
| C. | CH4的结构式: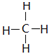 | D. | HF的电离方程式:HF?F-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有I- | B. | 一定含有CO32- | C. | 一定含有NH4+ | D. | 一定含有Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ka(H2CO3)<Ka(CH3COOH)说明相同物质的量浓度时,碳酸的酸性比醋酸的强 | |
| B. | 一般情况下,当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)均变大 | |
| C. | 在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大 | |
| D. | 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池外电路中电子由负极流向正极 | |
| B. | 原电池中发生还原反应的电极是正极 | |
| C. | 电解池中发生还原反应的电极是阳极 | |
| D. | 电解池中质量增加的电极是阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
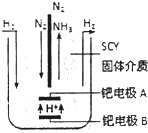 氨和联氨(N2H4)是氮的两种常见化合物,在工农业生产中有重要的应用.
氨和联氨(N2H4)是氮的两种常见化合物,在工农业生产中有重要的应用. [N2H5•H2O]++H+.下列盐酸肼溶液中的离子浓度关系正确的是ac(填序号).
[N2H5•H2O]++H+.下列盐酸肼溶液中的离子浓度关系正确的是ac(填序号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(CH3COO-)的CH3COOH与CH3COONa的混合溶液 | |
| B. | 常温下,pH=3的CH3COOH与pH=11的NaOH溶液等体积混合 | |
| C. | 含OH-的溶液 | |
| D. | 滴加甲基橙后溶液显红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com