
【题目】航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。
Sabatier反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
水电解反应:2H2O(l)![]() 2H2(g)+O2(g)
2H2(g)+O2(g)
(1)将原料气按![]() ∶
∶![]() =1∶4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
=1∶4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
① 该反应的平衡常数K随温度升高而__________(填“增大”或“减小”)。

② 温度过高或过低均不利于该反应的进行,原因是________。
③ 200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为________。(不必化简。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化效率的是______(填标号)。
A.适当减压
B.增大催化剂的比表面积
C.反应器前段加热,后段冷却
D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
(3)一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)![]() C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。
① 已知CO2(g)、H2O(g)的生成焓分别为–394 kJmol-1、–242 kJmol-1,Bosch反应的ΔH =________kJmol-1。(生成焓指一定条件下由对应单质生成1mol化合物时的反应热)
② 一定条件下Bosch反应必须在高温下才能启动,原因是________。
③ 新方案的优点是________。
【答案】 减小 温度过低,反应速率减小 温度过高,反应向右进行的程度小  BCE -90 反应的活化能高;氢原子利用率为100%。
BCE -90 反应的活化能高;氢原子利用率为100%。
【解析】(1)①根据H2O(g)的物质的量分数与温度的关系图可得:温度越高,H2O(g)的物质的量分数越低,故随升高温度该反应的平衡常数K减小。②温度过低,反应速率很小;温度过高,反应向右进行的程度小,故温度过高或过低均不利于该反应的进行。③200℃时平衡体系中H2O(g)的物质的量分数为0.6,根据反应化学方程式CO2(g)+4H2(g)![]() CH4(g)+2H2O(g),所以CH4的物质的量分数为0.3,因此CO2和H2的物质的量分数共为0.1,又因为原料气按
CH4(g)+2H2O(g),所以CH4的物质的量分数为0.3,因此CO2和H2的物质的量分数共为0.1,又因为原料气按![]() ∶
∶![]() =1∶4置于密闭容器中发生Sabatier反应,所以CO2的物质的量分数为0.02,H2的物质的量分数为0.08;达到平衡时体系的总压强为p,则四种物质的分压分别为:p(CO2)=0.02p、p(H2)=0.08p、p(CH4)=0.3p、p(H2O)=0.6p,所以该反应平衡常数Kp为:
=1∶4置于密闭容器中发生Sabatier反应,所以CO2的物质的量分数为0.02,H2的物质的量分数为0.08;达到平衡时体系的总压强为p,则四种物质的分压分别为:p(CO2)=0.02p、p(H2)=0.08p、p(CH4)=0.3p、p(H2O)=0.6p,所以该反应平衡常数Kp为:![]() =
=![]() 。
。
(2)首先明确:转化效率不等于转化率。A项,适当减压化学反应速率降低、降低平衡转化率,故A错误;B项,增大催化剂的比表面积,提高了化学反应速率,能提高CO2转化效率,故B正确;C项,反应器前段加热,加快反应速率,后段冷却,提高平衡转化率,故C正确;D项,提高原料气中CO2所占比例,降低CO2的转化率,故D错误;E项,合理控制反应器中气体的流速,可使反应物充分反应,提高了CO2转化效率,故E正确。综上,选BCE。
(3)①由已知可得:C(s)+O2(g)=CO2(g) ΔH =–394 kJmol-1,2H2(g)+O2(g)=2H2O(g) ΔH =–484 kJmol-1,所以Bosch反应CO2(g)+2H2(g)![]() C(s)+2H2O(g)的ΔH=[–484-(-394)] kJmol-1=-90kJmol-1。②Bosch反应为放热反应,一定条件下必须在高温下才能启动,说明高温条件才能引发此反应开始,故该反应的活化能很高。③新方案与原方案相比氢原子利用率为100%。
C(s)+2H2O(g)的ΔH=[–484-(-394)] kJmol-1=-90kJmol-1。②Bosch反应为放热反应,一定条件下必须在高温下才能启动,说明高温条件才能引发此反应开始,故该反应的活化能很高。③新方案与原方案相比氢原子利用率为100%。


科目:高中化学 来源: 题型:
【题目】【化学—选修3: 物质结构与性质】
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
① Ti的基态原子价电子排布式为 。
② Fe的基态原子共有 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3 CCl4==="2" KCl+2 CrO2Cl2+3 COCl2↑。
① 上述化学方程式中非金属元素电负性由大到小的顺序是 (用元素符号表示)。
② COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为 ,中心原子的杂化方式为 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO (填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为 。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是 cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力=![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼锌厂的铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。对这些元素进行提取分离能减少环境污染,同时制得ZnSO4·7H2O实现资源的再利用。其流程图如下。已知FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。

金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
开始沉淀pH | 2.7 | 6.5 | 7.7 | 5.2 | 6.9 |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:
(1)提高浸出率可以采用的方法是(写出其中一点即可)______________。
(2)滤液I中有少量的AsO33-,若不除去,则AsO33-与Cd反应会产生一种有毒氢化物气体,该气体的分子式为_________。向滤液I中逐滴滴人酸性KmnO4溶液可与AsO33-发生反应生成FeAsO4,完成该反应的离子方程式:_________
___Fe2++___AsO33-+___MnO4-+ □= Mn2++ FeAsO4↓+ □,判断该滴定终点的现象是_______。
(3)流程中②调节pH时可以选用的试剂为________,滤渣Ⅱ的主要成份为________。
(4)常温下Zn(OH)2的溶度积Ksp=_____________________。
(5)制得的ZnSO4 7H2O需洗涤,洗涤晶体时应选用试剂为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热NaHCO3的饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)写出NaHCO3水解的离子方程式__________,甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强。
(2)乙同学认为溶液的pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度_______NaHCO3(选填“>”、“<”或“=”)
(3)丙同学认为甲、乙的判断都不充分。丙认为:
①只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则_______(选填“甲”或“乙”)判断正确。试剂X是_________。
A. Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
②将加热后的溶液冷却到10℃,若溶液的pH____8.3(选填“>”、“<”或“=”),则__________(选填“甲”或“乙”)判断正确。
③查阅资料,发现NaHCO3的分解温度为150℃,丙断言_____(选填“甲”或“乙”)的判断是错误的,理由是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. ![]() 和
和 ![]() 均是芳香烃,
均是芳香烃,![]() 既是芳香烃又是芳香化合物
既是芳香烃又是芳香化合物
B. 邻二甲苯的一氯取代物有2种
C. 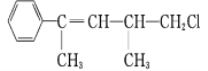 在加热和催化剂作用下,最多能与4 mol H2反应
在加热和催化剂作用下,最多能与4 mol H2反应
D. 由乙烯推测丙烯的结构,丙烯分子中所有原子都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浮选凝聚法处理酸性污水的工作原理如图所示,下列说法不正确的是

A. 通入甲烷的石墨电极的电极反应式为:CH4+10OH--8e-═CO32-+7H2O
B. 通入空气的石墨电极的电极反应式为O2+2CO2+4e-═2CO32-
C. Fe电极的电极反应式为:Fe-2e-═Fe2+
D. 为增强污水的导电能力,可向污水中加入适量工业用食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)阅读、分析下列两个材料:
材料一
物质 | 熔点/℃ | 沸点/℃ | 密度/g/cm3 | 溶解性 |
乙二醇 | 11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
材料二

回答下列问题(填序号):
A.蒸馏法 B.萃取法 C.“溶解、结晶、过滤”的方法 D.分液法
①将纯碱从氯化钠和纯碱的混合物中分离出来,最好用 ;
②将乙二醇和丙三醇相互分离的最佳方法是___________。
(2)阅读材料三
在溶解性方面,Br2(溴)与I2很相似,其稀的水溶液显黄色。在实验室里从溴水(Br2的水溶液)中提取Br2和提取I2的方法相似。
回答下列问题:
①常用的提取方法是____________,化学试剂是 ,最主要的仪器是 。
②若观察发现提取Br2以后的水还有颜色,解决该问题的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质性质或用途的说法正确的是( )
A. 浓硫酸具有强氧化性,故不可用作干燥二氧化硫气体
B. 明矾可用作净水剂、晶体硅用来制作光导纤维
C. 稀硫酸中加入KNO3可使金属铜溶解
D. 氯气通入品红溶液中溶液褪色,说明Cl2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是学习化学的基础,要通过实验去学习化学。
(1)下列关于实验的叙述中正确的有________。
A.不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抺布灭火
B.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗
C.用托盘天平称量物品质量时,物品应置于右盘
D.实验时应节约药品,实验剩余的药品应放回原试剂瓶
E.可燃性气体点燃前一定要验纯
(2)请将下列错误实验操作可能会引起的不良后果填在表格中。
实验 | 向试管中加锌粒 | 对量筒中液体读数 | 浓硫酸的稀释 |
错误操作 |
|
|
|
不良后果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com