
| 反应物 | 甲 | 乙 | 丙 |
| A | 2 | 1 | 1 |
| B | 1 | 2 | 1 |
| A. | A的转化率甲<丙<乙 | B. | A的转化率甲<乙<丙 | ||
| C. | B 的转化率甲>丙>乙 | D. | B的转化率甲<乙<丙 |
分析 甲相当于在丙的基础上再增加A的物质的量,所以甲中B的转化率大于丙中B的转化率,但A的转化率要小于丙中A的转化率;乙相当于在丙的基础上再增加B的物质的量,所以乙中A的转化率大于丙中A的转化率,但B的转化率要小于丙中B的转化率,由此分析解答.
解答 解:将起始时情况作如下排列:
2A(g)+B(g)?3C(g)+2D(g)
甲 2 mol 1 mol
乙 1 mol 2 mol
丙 1 mol 1 mol
A越少B越多,A的转化率越高,增大反应物A(g)的浓度,A的转化率减少,B的转化率增大;减少反应物A(g)的浓度,A的转化率增大,B的转化率减少,所以A的转化率甲<丙<乙,B 的转化率甲>丙>乙,故选:A、C.
点评 本题考查影响化学平衡移动的因素,题目难度中等,注意对比三种容器内各物质的物质的量关系,结合影响平衡移动的因素解答.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
 常温下向20mL 0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
常温下向20mL 0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a点表示的溶液中c(CH3COO-)略小于10-3mol/L | |
| B. | b点表示的溶液中c(CH3COO-)>c(Na+) | |
| C. | c点表示CH3COOH和NaOH恰好完全中和 | |
| D. | 滴定过程中溶液中的n (CH3COO-)+n(CH3COOH)的和不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaClO溶液通入少量SO2气体:3ClO-+SO2+H2O=SO${\;}_{4}^{2-}$+Cl-+2HCl | |
| B. | 将过量的Cl2通入FeBr2中:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | |
| C. | 向碳酸氢钙溶液滴加氢氧化钠溶液至Ca2+恰好完全沉淀:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液至沉淀量最大:NH4++Al3++2SO42-+2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3.H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
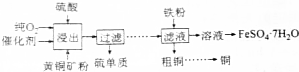
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知制备甲醇的有关化学反应及平衡常数如表所示:
已知制备甲醇的有关化学反应及平衡常数如表所示:| 化学反应 | 反应热 | 平衡常数(850℃) |
| ①CO2 (g)+3H2 (g)═CH3OH(g)+H2O(g) | △H1=-48.8 kJ•molˉ1 | K1=320 |
| ②CO(g)+H2O(g)═H2(g)+CO2(g) | △H2=-41.2 kJ•molˉ1 | K2 |
| ③CO(g)+2H2(g)═CH3OH(g) | △H3 | K3=160 |
| 物质 | H2 | CO2 | CH3OH | H2O |
| 浓度(mol•Lˉ1) | 0.2 | 0.2 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
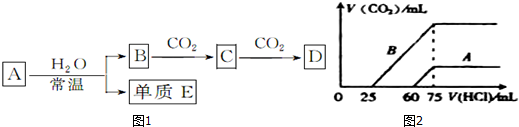
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
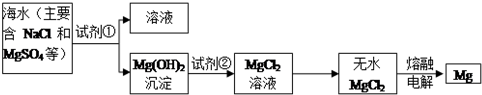
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com