
已知1 mol红磷转化为1 mol白磷,吸收18.39 kJ热量。
①4Ps,红)+5O2g)===2P2O5s) ΔH1
②4Ps,白)+5O2g)===2P2O5s) ΔH2
则ΔH1与ΔH2的关系正确的是 )。
A.ΔH1=ΔH2 B.ΔH1>ΔH2
C.ΔH1<ΔH2 D.无法确定
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案科目:高中化学 来源: 题型:
对于可逆反应mA(g)+nB(s)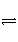
 pC(g)+qD(g),反应过程中,其他条件不变时,产物D的物质的量分数D%与温度T或压强p的关系如下图,下列说法正确的是( )
pC(g)+qD(g),反应过程中,其他条件不变时,产物D的物质的量分数D%与温度T或压强p的关系如下图,下列说法正确的是( )
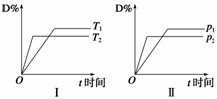
A.降温可使化学平衡向正反应方向移动
B.使用合适的催化剂可使D%有所增加
C.化学方程式中化学计量数:m>p+q
D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.石油分馏、煤的气化、海水制食盐、蛋白质变性等过程都包含化学变化
B. 酸性氧化物一定不能和酸反应
C. 稀豆浆、硅酸、氯化铁溶液均为胶体
D.爆鸣气、铝热剂、玻璃、花生油、聚乙烯均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是 )。
A.K值不变,平衡可能移动
B.K值变化,平衡一定移动
C.平衡移动,K值可能不变
D.平衡移动,K值一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是双选) )。
A.已知在T ℃时,反应2Ag)+Bg)3Cg) ΔH>0的正反应速率表示为v,若降低温度,正反应速率减小,逆反应速率增大
B.在恒容容器中发生反应N2g)+3H2g)2NH3g),若往容器中充入He,正逆反应的速率均不变
C.当一定量的锌粉和4 mol·L-1的过量盐酸反应时,为了减慢反应速率,又不影响产生H2的总量,可向容器中加入一些水或硝酸钠溶液
D.对任何一个化学反应,温度发生变化,化学反应速率一定发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
4种短周期主族元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1∶2,X2+和Z-的电子数之差为8。下列说法不正确的是 )。
A.W与Y通过离子键形成离子化合物
B.元素原子半径从大到小的顺序是X>Y>Z
C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构
D.W、Y、Z元素的最高价氧化物对应的水化物中酸性最强的元素是Z
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z最外层电子数之和为15,X、Y在同一周期,X+、Z-具有相同的核外电子层结构。下列推测错误的是 )。
A.同主族元素中Z的氢化物稳定性最强
B.同周期元素中X的金属性最强
C.原子半径X>Y,离子半径X+>Y-
D.同周期元素中Y的最高价含氧酸的酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
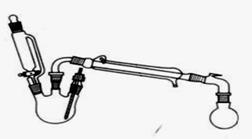
某研究性小组探究乙酸乙酯的反应机理,实验如下:
CH3COOH + C2H5OH  CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
投料 1 : 1 CH3COOH转化率 65%
1 : 10 CH3COOH转化率 97%
(在120 ℃下测定)
|
已知:相关物理性质(常温常压)
| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | −84 | 76.5 | 不溶 |
合成反应:
在三颈瓶中加入乙醇5 mL,硫酸5 mL,2小片碎瓷片。漏斗加入乙酸14.3 mL ,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)酯化反应的机理
用乙醇羟基氧示踪
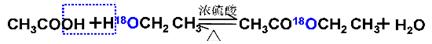

用醋酸羟基氧示踪
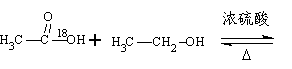
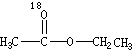
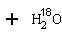
含氧18水占到总水量的一半,酯也一样。这个实验推翻了酯化反应为简单的取代反应。请你设想酯化反应的机理
。
(2)酯化反应是一个可逆的反应,120 ℃时,平衡常数K= 。
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)浓硫酸与乙醇如何混合? 。
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是? 。
(6)蒸出的粗乙酸乙酯中主要有哪些杂质? 。
饱和的Na2CO3溶液洗涤除去乙酸。如何判断是否除净? 。
用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水? 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在碘酸钠(NaIO3)的碱性溶液中通入氯气,可以得到高碘酸钠(Na2H3IO6)。下列有关该反应的说法错误的是( )
A.在该反应中碘酸钠作还原剂
B.碱性条件下,氯气的氧化性强于高碘酸钠的氧化性
C.反应中生成1 mol Na2H3IO6转移2 mol电子
D.反应中氧化产物与还原产物的物质的量之比为2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com