
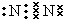
 4NO + 6H2O
4NO + 6H2O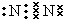 ,故答案为:
,故答案为: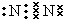 ;
;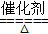 4NO + 6H2O,故答案为4NH3 + 5 O2
4NO + 6H2O,故答案为4NH3 + 5 O2 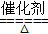 4NO + 6H2O。
4NO + 6H2O。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源:不详 题型:填空题








查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH3易液化,液氨常用作制冷剂 |
| B.与铜反应时,浓硝酸被还原成NO2而稀HNO3被还原成NO,所以稀HNO3氧化性强于浓HNO3 |
| C.氨盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处 |
| D.氨水逐滴滴加到硝酸银溶液中,先出现沉淀,后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两种分子的中心原子的杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 |
| D.氨气分子是极性分子而甲烷是非极性分子 |
查看答案和解析>>
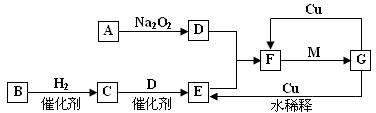
科目:高中化学 来源:不详 题型:问答题
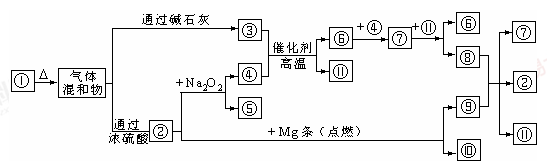
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1/14mol /L | B.1/22.4mol/L | C.1/28mol/L | D.1/42mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
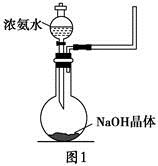

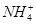 +OH-,NaOH晶体使该可逆反应的平衡向左移动
+OH-,NaOH晶体使该可逆反应的平衡向左移动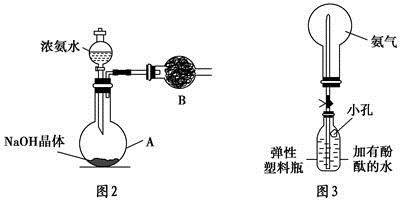
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| pH范围 | >7 | <7 |
| 产物 | NO3- | NO、N2O、N2中的一种 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
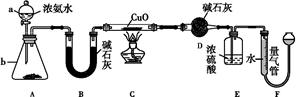
| A.Cl2 | B.O2 | C.CO2 | D.NO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com