
姜黄素的合成路线如图所示:

已知:①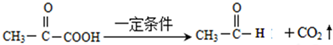
②
请回答下列问题:
(1)D中含有的官能团名称是__________,D→E的反应类型是__________。
(2)姜黄素的结构简式为__________。
(3)反应A→B的化学方程式为__________。
(4)D的催化氧化产物与B可以反应生成一种高分子化合物,其结构简式为__________。
(5)下列有关E的叙述不正确的是__________(填序号).
a.能发生氧化、加成、取代和缩聚反应
b.1molE与浓溴水反应最多消耗3mol的Br2
c.E能与FeCl3溶液发生显色反应
d.1molE最多能与3molNaOH发生反应
(6)G香兰醛(C8H8O3)的同分异构体中,符合下列条件的共有__________种,其中核磁共振氢谱中有4组吸收峰的同分异构体的结构简式为__________
①属于酯类;②能发生银镜反应;③苯环上的一取代物只有2种;
科目:高中化学 来源:2016届黑龙江哈尔滨六中高三下三模理综化学试卷(解析版) 题型:选择题
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg的变化如图所示,下列叙述正确的是
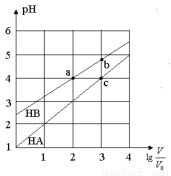
A.相同条件下NaA溶液的pH大于NaB溶液的pH
B.溶液中水的电离程度:a=c>b
C.该温度下HB的电离平衡常数约等于1.11×10-5
D.当lg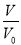 =3时,若两溶液同时升高温度,则
=3时,若两溶液同时升高温度,则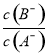 减小
减小
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三临考模拟化学试卷(解析版) 题型:选择题
以下关于胶体的说法不正确的是
A.胶体粒子能透过滤纸,但不能透过半透膜
B.Fe(OH)3胶体粒子具有较大的表面积,具有吸附性,能吸附阳离子,故在电场作用下会产生电泳现象
C.向Fe(OH)3胶体中逐滴滴入稀硫酸,会先出现红褐色沉淀然后沉淀消失的现象
D.只有胶体粒子能作布朗运动
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前预测化学试卷(解析版) 题型:选择题
一定条件下,在容积为10L密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),30min后测得生成0.04molNH3。在这段时间内H2的化学反应速率为( )
2NH3(g),30min后测得生成0.04molNH3。在这段时间内H2的化学反应速率为( )
A.0.0004mol/(L•min)
B.0.0002mol/(L•s)
C.0.0016
D.0.0002 mol/(L•min)
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三第八次月考理综化学试卷(解析版) 题型:推断题
已知 X、Y、U、V、W、Z是六种常见元素,其中X、Y、U、V、W五种短周期元素在周期表中的位置如图所示:U的最简单气态氢化物能使湿润的红色石蕊试纸变蓝.Z是人体血红蛋白中存在的金属元素.请回答下列问题:
Y | U | |||
X | V | W |
(1)Z元素在周期表中的位置__________,ZW3的水溶液可以净水的原因是__________(用离子方程式、结合文字说明)
(2)X、U、V、W形成的简单离子半径由大到小的顺序为__________(用离子符号表示)
(3)若将少量U的最简单氢化物与过量W的单质混合,则生成一种酸和另一种化合物A,A中所有原子均满足8电子稳定结构,试写出A的电子式__________,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式__________。
(4)二氧化钛(TiO2)与X的单质、Y的单质高温下反应生成两种化合物,这两种化合物均由两种元素组成,其反应的化学方程式为__________,若有1molX的单质参加反应,转移的电子数目为__________。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三第八次月考理综化学试卷(解析版) 题型:选择题
化学与社会、生活、技术和环境密切相关,下列说法正确的是( )
A.绿色化学的核心就是治理工业生产对环境产生的污染
B.铁、钙、碘都是人体必不可少的微量元素
C.苹果放在空气中久置变黄和纸张久置变黄原理相似
D.生活中常用的塑料制品及橡胶制品都为高分子材料
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二5月月考化学试卷(解析版) 题型:填空题
某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B═H++HB-;HB- H++B2-,回答下列问题:
H++B2-,回答下列问题:
(1)NaHB溶液显___________(填“酸性”、“中性”或“碱性”或“酸碱性无法确定”),理由是___________。
(2)某温度下,向0.1mol/L的NaHB溶液中滴入0.1mol/LKOH溶液至中性,此时溶液中以下关系一定正确的是___________(填字母).
A.c(H+)•c(OH-)═1×10-14 mol2/L2
B.c(Na+)+c(K+)═c(HB-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)═0.05mol/L
(3)已知常温下H2B的钙盐(CaB)饱和溶液中存在以下平衡:CaB(s)  Ca2+(aq)+B2-(aq)△H>0.
Ca2+(aq)+B2-(aq)△H>0.
①温度升高时,Ksp ___________(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)___________,原因是___________(用文字和离子方程式说明)。
(4) 已知0.1mol•L-1NaHB溶液的pH=2,则0.1mol•L-1H2B溶液中氢离子的物质的量浓度可能是___________0.11mol•L-1(填“<”、“>”、或“=”); 理由是___________。
(5)0.1 mol/L NaHB溶液中各种离子浓度由大到小的顺序是___________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省汕头市高二下期末化学试卷(解析版) 题型:选择题
关于工业转化图(见图),下列说法不正确的是

A.该过程是一种“对环境友好型”工业生产硫酸的方法
B.从以上物质的转化过程可看出硫酸可作乙烯水化法制乙醇的催化剂
C.该过程中①②是加成反应
D.该过程中③④是酯类的水解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com