
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:


回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为___________________。“酸浸”实验中为了提高酸浸的效率,除了升温还可以采取的措施有___________________(至少写两种)。
(2)“酸浸”后,“滤液①”钛主要以![]() 形式存在,写出其水解生成TiO2·xH2O的离子方程式__________________。
形式存在,写出其水解生成TiO2·xH2O的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40 ℃时TiO2·xH2O转化率最高的原因__________________。
(4)若“滤液②”中![]() ,加入双氧水和磷酸(设溶液体积增加1倍),使
,加入双氧水和磷酸(设溶液体积增加1倍),使![]() 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中![]() ,此时是否有Mg3(PO4)2沉淀生成?_____________(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为
,此时是否有Mg3(PO4)2沉淀生成?_____________(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为![]() 。
。
【答案】100℃、 2h , 90℃ 、 5h 适当增加盐酸的浓度、将钛铁矿粉碎等 TiOCl42-+(x+2)H2O==4Cl-+TiO2·xH2O↓+2H+ 低于40℃,TiO2·xH2O转化反应速率随温度升高而增加;超过40℃,双氧水分解与氨气逸出导致TiO2·xH2O转化反应速率下降 Fe3+恰好沉淀完全时,c(PO43-)=![]() mol·L1=1.3×10–17 mol·L1,c3(Mg2+)×c2(PO43-)=(0.01)3×(1.3× 10–17)2=1.7× 10–40<Ksp [Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀
mol·L1=1.3×10–17 mol·L1,c3(Mg2+)×c2(PO43-)=(0.01)3×(1.3× 10–17)2=1.7× 10–40<Ksp [Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀
【解析】
用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备Li4Ti5O12和LiFePO4,由制备流程可知,加盐酸过滤后的滤渣为SiO2,滤液①中含Mg2+、Fe2+、Ti4+,水解后过滤,沉淀为TiO2.xH2O,与双氧水反应Ti元素的化合价升高,生成(NH4)2Ti5O15,与LiOH反应后过滤得到Li2Ti5O15,再与碳酸锂高温反应生成Li4Ti5O12;水解后的滤液②中含Mg2+、Fe2+,双氧水可氧化亚铁离子,在磷酸条件下过滤分离出FePO4,高温煅烧②中发生2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O+3CO2↑,以此来解答。
2LiFePO4+H2O+3CO2↑,以此来解答。
(1)由图可知,当铁的浸出率为70%时,所采用的实验条件为选择温度为100℃、2h或90℃、5h;
“酸浸”实验中为了提高酸浸的效率,除了升温还可以采取的措施有适当增加盐酸的浓度、将钛铁矿粉碎等;
(2)“酸浸”后,钛主要以TiOCl42-形式存在,水解生成TiO2·xH2O的离子方程式TiOCl42-+(x+2)H2O==4Cl-+TiO2·xH2O↓+2H+;
(3)40℃时TiO2xH2O转化率最高,低于40℃,TiO2·xH2O转化反应速率随温度升高而增加;超过40℃,双氧水分解与氨气逸出导致TiO2·xH2O转化反应速率下降;
(4)Fe3+恰好沉淀完全时,c(PO43-)=![]() mol·L1=1.3×10–17 mol·L1,c3(Mg2+)×c2(PO43-)=(0.01)3×(1.3× 10–17)2=1.7× 10–40<Ksp [Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀。
mol·L1=1.3×10–17 mol·L1,c3(Mg2+)×c2(PO43-)=(0.01)3×(1.3× 10–17)2=1.7× 10–40<Ksp [Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图所示。若上端开口关闭,可得到强还原性的H·(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(羟基自由基)。下列说法错误的是

A. 无论是否鼓入空气,负极的电极反应式均为Fe-2e—===Fe2+
B. 不鼓入空气时,正极的电极反应式为H++e—===H·
C. 鼓入空气时,每生成1mol·OH有2 mol电子发生转移
D. 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列烷烃的系统名称:
①![]() ______________________________________.
______________________________________.
② _______________________________________ .
_______________________________________ .
③ ___________________________________ .
___________________________________ .
④ ____________ ;
____________ ;
(2)根据下列有机物的名称,写出相应的结构简式:
①2,4二甲基戊烷 ______ .
②2,2,5三甲基3乙基己烷 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是生活中应用非常广泛的一种二次电池,关于其工作原理下列说法中正确的是
A. 放电时,负极电极溶解,电极质量减小
B. 放电时,电解质溶液中的H+向负极移动
C. 放电时,正极的反应式是: PbO2+SO42-+4H++2e-═PbSO4+2H2O
D. 充电时,当有20.7gPb生成时,转移的电子为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H是一种重要的高分子化合物,其合成路线如下:
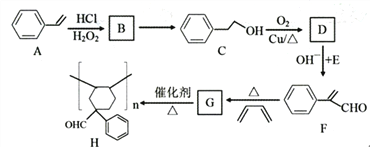
已知:
请回答下列问题:
(1)A的名称是_______________,C中含氧官能团名称是______________。
(2)写出反应类型:A→B______________,C→D__________________。
(3)B→C的反应试剂和反应条件是______________________。
(4)D+E→F的反应方程式是_________________。
(5)G的分子式是____________________。
(6)满足下列条件的F的同分异构体共有__________种(不考虑立体异构)。
a.苯环上有两个取代基,无其他环状结构;b.含碳碳三键,无-C≡COH结构。
(7)多环化合物是有机研究的重要方向,请设计由![]() 、.CH3CHO、
、.CH3CHO、![]() -CHO合成多环化合物
-CHO合成多环化合物 的路线(无机试剂任选)______________
的路线(无机试剂任选)______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期过渡元素如铁、锰、铜、锌等在太阳能电池、磁性材料等科技方面有广泛的应用,回答下列问题:
(1)Fe的基态原子共有____种不同能级的电子。
(2)已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是___。比较铁与锰的第三电离能(I3):铁__锰(填“>”、 “=”或“<”),原因是___。
(3)某含铜化合物的离子结构如图所示。

①该离子中存在的作用力有______________;
a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
②该离子中N原子的杂化类型有____________。
(4)如图是晶体Fe3O4的晶胞,该晶体是一种磁性材料,能导电。
①晶胞中二价铁离子处于氧离子围成的______(填空间结构)空隙。
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为________。
③解释Fe3O4晶体能导电的原因__________;若晶胞的体对角线长为anm,则 Fe3O4 晶体的密度为______g·cm-3(阿伏加德罗常数用NA表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲醛分子的模型,根据该图和所学化学知识回答下列问题:
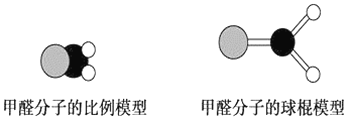
(1)甲醛分子中碳原子的杂化方式是__________,作出该判断的主要理由是__________________________。
(2)下列是对甲醛分子中碳氧键的判断,其中正确的是________(填序号)。
①单键 ②双键 ③σ键 ④π键 ⑤σ键和π键
(3)甲醛分子中C—H键与C—H键间的夹角________(填“=”、“>”或“<”)120°,出现该现象的主要原因是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A. 制乙酸乙酯时,将乙醇注入浓硫酸中,冷却后加入乙酸
B. 向溴乙烷中滴加硝酸酸化的AgNO3溶液,以检验其中的溴元素
C. 用氢氧化钠溶液清洗盛过苯酚的试管
D. 在试管中加入2mL2%的CuSO4溶液,然后加入4至6滴10%的NaOH溶液振荡、再加入几滴乙醛溶液加热煮沸,可以检验乙醛分子中的醛基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法正确的是( )

A. 电极b反应式是O2+4e-+2H2O=4OH-
B. 电解后乙装置d电极附近溶液的pH不变
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 甲中每消耗1mol SO2,乙装置中有1mol H+通过隔膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com