
| 编号 | 1 | 2 | 3 |
| 溶液的体积/ml | 10.00 | 10.00 | 10.00 |
| 消耗Na2S2O3标准溶液的体积/ml | 19.95 | 17.10 | 20.05 |
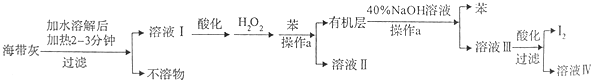
分析 海带灰加入水溶解后加热2-3分钟过滤得到溶液Ⅰ中含碘离子,加入酸酸化,加入过氧化氢氧化碘离子生成碘单质,加入苯萃取分液得到有机层为含碘单质的苯溶液,加入40%的NaOH溶液反萃取分液,得到溶液Ⅲ中为碘离子和碘酸根离子的溶液,加入酸酸化过滤得到碘单质,
(1)升温能加快溶解速率,碘单质在苯中溶解度大于水中的溶解度,利用萃取分液的方法分离得到有机层;
(2)酸化的溶液Ⅰ中加入过氧化氢是氧化碘离子生成碘单质;
(3)碘单质和氢氧化钠溶液反应属于歧化反应,碘元素化合价降低为-1价得到还原产物,升高为正价得到氧化产物,氧化产物和还原产物的物质的量之比为1:5,结合电子守恒计算升高的化合价,据此书写化学方程式;
(4)I2需要进行洗涤和干燥洗涤,洗涤液不能和碘单质发生反应,不能溶解碘单质;
(5)以淀粉溶液为指示剂,用浓度为0.050mol/LNa2S2O3的标准溶液进行滴定,终点现象为溶液由蓝色恰好变为无色且半分钟内不褪色;依据反应的定量关系 2S2O32-+I2→S4O62-+2I-.计算硫代硫酸钠消耗的碘单质,计算得到碘单质在产品中的质量分数.
解答 解:(1)溶解海带灰时要加热煮沸2~3min是加快溶解速率,使碘离子全部溶解,操作a是分离碘单质的水溶液,加入苯溶液除去碘单质分层分液得到含碘单质的有机层,a操作的名称为分液,
故答案为:加快I-溶解,使海带灰中I-尽可能全部溶解;分液;
(2)向酸化的溶液I中加入H2O2的目的为将I-氧化为I2,
故答案为:将I-氧化为I2;
(3)碘单质和氢氧化钠溶液反应属于歧化反应,碘元素化合价降低为-1价得到还原产物,升高为正价得到氧化产物,氧化产物和还原产物的物质的量之比为1:5,结合电子守恒计算升高的化合价为x,1×(x-0)=5×[0-(-1)],x=+5,反应的化学方程式为:3I2+6NaOH=NaIO3+5NaI+3H2O,
故答案为:3I2+6NaOH=NaIO3+5NaI+3H2O;
(4)I2需要进行洗涤和干燥洗涤,洗涤液不能和碘单质发生反应,不能溶解碘单质,
A.水能溶解碘单质,故A错误;
B.碘单质易溶于乙醇,不能用乙醇洗涤碘单质,故B错误;
C.碘单质在冷水中溶解性不大,可以用来洗涤碘单质,故C正确;
D.碘单质易溶于乙醇的水溶液,不能用来洗涤,故D错误,
故答案为:C;
(5)以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,终点现象为蓝色溶液恰好变为无色且半分钟内不褪色;根据表中数据可知,第二次实验中消耗标准溶液的体积偏小,舍去,则实际消耗Na2S2O3标准溶液的体积的平均值是=$\frac{19.95+20.05}{2}$=20ml,
则根据反应的方程式可知,2S2O32-+I2→S4O62-+2I-,
2 1
0.020L×0.05mol/L n(I2)
所以样品中I2的物质的量是0.050mol/L×0.0200L×$\frac{1}{2}$×10=0.005mol,则碘单质在产品中的质量分数=$\frac{0.005mol×254g/mol}{5.0g}$×100%=25.4%;
故答案为:加入最后一滴标准溶液后,蓝色溶液恰好变为无色且半分钟内不褪色;25.4%.
点评 本题考查了海水资源的利用、碘单质的制备、物质性质分析判断等知识点,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 10 g H218O中所含的中子数为5NA | |
| B. | 1 mol 铁单质与足量的硫单质充分反应,电子转移数目为3NA | |
| C. | 在1 L 0.1mol/L的NH4Cl溶液中,阴、阳离子总数小于0.2NA | |
| D. | 一定条件下,将1mol N2和3mol H2充分反应,产物分子数目小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
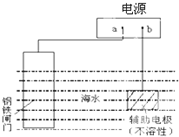
| A. | 图所示是牺牲阳极阴极保护法 | |
| B. | a为电源正极 | |
| C. | 电子流向:a→铁闸门,辅助电极→b | |
| D. | 辅助电极上的反应:O2+2H2O+4e→4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )| A. | 点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+) | |
| B. | 点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) | |
| C. | 点c所示溶液中:c(SO42-)+c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 点d所示溶液中:c(SO42-)>c(NH3•H2O)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 向次氯酸钙溶液通入少量CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | |
| C. | 实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2Cl-+Cl2↑+2H2O | |
| D. | 向NH4HCO3溶液中加过量的NaOH溶液:NH4++OH-=NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X溶液 | 固体Y |  |
| A | 浓硫酸 | 铜粉 | |
| B | 浓氨水 | CaO | |
| C | 稀盐酸 | 石灰石 | |
| D | 浓盐酸 | 高锰酸钾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3的物质的量为4.5mol的状态为平衡状态 | |
| B. | O2的平均反应速率为0.4amol•(L•min)-1 | |
| C. | SO2和O2的反应百分率相等 | |
| D. | 达到化学平衡状态时容器内压强减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com