
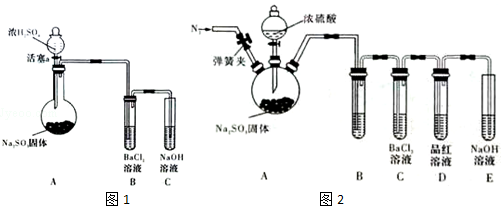
分析 (1)根据题意,碳酸钙与二氧化硫、氧气在高温条件下反应生成硫酸钙,同时生成二氧化碳;
(2)①假设生成的NaHSO3物质的量都为2mol,结合Na2SO3+SO2+H2O═2NaHSO3、NaOH+SO2═NaHSO3,c=$\frac{n}{V}$计算;
②NaOH溶液吸收了足量的SO2发生反应:NaOH+SO2═NaHSO3,与一定量的石灰水溶液发生NaHSO3+Ca(OH)2=CaSO3↓+NaOH+H2O;
(3)二氧化硫具有还原性易被氧气氧化成三氧化硫,与BaCl2溶液反应,三氧化硫与水反应生成硫酸,H2SO4+BaCl2=BaSO4↓+2HCl,A中产生的SO2与装置内空气中的O2进入B中与BaCl2溶液反应生成BaSO4沉淀;
③滴加浓硫酸之前打开弹簧夹,通入N2,排出装置中的氧气,然后滴加浓硫酸,Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,A中产生的白雾是酸雾;
④通过甲乙两位同学的实验,可知SO2与BaCl2溶液不反应.
解答 解:(1)根据题意,碳酸钙与二氧化硫、氧气在高温条件下反应生成硫酸钙,同时生成二氧化碳,所以反应的方程式为:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2,
故答案为:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2;
(2)①假设生成的NaHSO3物质的量都为2mol,Na2SO3+SO2+H2O═2NaHSO3,吸收的二氧化硫的物质的量为2mol,需1molNa2SO3,NaOH+SO2═NaHSO3,吸收的二氧化硫的物质的量也为2mol,需2molNaOH,假设Na2SO3溶液和NaOH溶液的物质的量浓度都为cmol/L,两种吸收液体积比V(Na2SO3):V(NaOH)=$\frac{1}{c}$:$\frac{2}{c}$=1:2,
故答案为:1:2;
②NaOH溶液吸收了足量的SO2发生反应:NaOH+SO2═NaHSO3,与一定量的石灰水溶液充分反应NaHSO3+Ca(OH)2=CaSO3↓+NaOH+H2O,离子反应为:Ca2++OH-+HSO3-=CaSO3↓+H2O,使NaOH溶液再生,
故答案为:Ca2++OH-+HSO3-=CaSO3↓+H2O;
(3)二氧化硫具有还原性易被氧气氧化成三氧化硫,与BaCl2溶液反应,三氧化硫与水反应生成硫酸,H2SO4+BaCl2=BaSO4↓+2HCl,
故答案为:A中产生的SO2与装置内空气中的O2进入B中与BaCl2溶液反应生成BaSO4沉淀;
③滴加浓硫酸之前打开弹簧夹,通入N2,排出装置中的氧气,然后滴加浓硫酸,Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,A中产生的白雾是浓硫酸的酸雾,所以B中的试剂是饱和NaHSO3,除去白雾,
故答案为:饱和NaHSO3;打开弹簧夹,通入N2,一段时间后关闭弹簧夹;
④通过甲乙两位同学的实验,得出的结论是SO2与BaCl2溶液不能得到BaSO3沉淀;不能用BaCl2溶液做吸收SO2的吸收液,
故答案为:SO2与BaCl2溶液不能得到BaSO3沉淀;不能用BaCl2溶液做吸收SO2的吸收液.
点评 本题考查物质的性质实验及环境污染,为高频考点,把握二氧化硫的性质、发生的反应、实验技能为解答的关键,侧重分析与实验能力的考查,注意二氧化硫具有还原性、盐酸的酸性大于亚硫酸的酸性,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ②④⑤①③⑥ | B. | ⑤④②①③⑥ | C. | ⑤④②③①⑥ | D. | ②④⑤③①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.1 g | B. | 10.2 g | C. | 13.6 g | D. | 15.3 g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
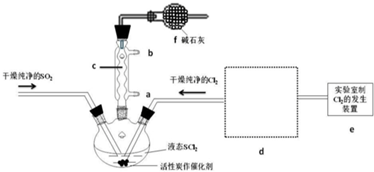
| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 |  |  |  |  |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | 70%H2SO4+K2SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com