
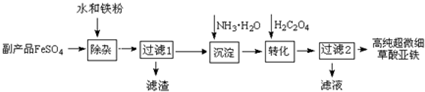


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把100 mL 3 mol/L的H2SO4跟100 mL 水混合,硫酸的物质的量浓度变为1.5 mol/L |
| B、把200 mL 3 mol/L的BaCl2溶液跟100 mL 3 mol/L的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol/L |
| C、把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10% |
| D、把100 mL 1 mol/L的NaOH溶液取出10 mL后,NaOH溶液的浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述实验中,共有两个氧化还原反应 |
| B、上述实验证明还原性:Fe2+>Br->Cl->Mn2+ |
| C、实验①生成的气体不能使湿润的淀粉KI试纸变蓝 |
| D、实验③证明Fe2+既有氧化性又有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
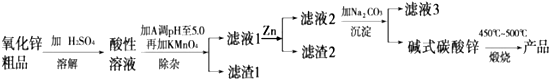
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com