
【题目】写出下列反应的化学(离子)方程式
(1)HF不能装在玻璃瓶中,对应发生的化学方程式________
(2)NO2与一定量的O2混合通入水中,完全被水吸收的离子方程式________
(3)Pb的常见化合价是+2价和+4价,PbO2的某些化学性质与MnO2相似。写出实验室用PbO2与浓盐酸混合加热制氯气的化学方程式________
(4)SO2气体使溴水褪色的离子方程式________
(5)煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1.(溶液呈碱性)反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42- | SO32- | NO3- | NO2- | Cl= |
c/(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
写出NaClO2溶液脱硝过程中主要反应的离子方程式 ________。
【答案】SiO2+4HF=SiF4↑+2H2O 4NO2+O2+2H2O=4H++4NO3- PbO2+4HCl![]() PbCl2+Cl2↑+2H2O SO2+Br2+2H2O=4H++2Br-+SO42- 3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O
PbCl2+Cl2↑+2H2O SO2+Br2+2H2O=4H++2Br-+SO42- 3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O
【解析】
(1)常温下,玻璃中含有SiO2,二氧化硅与氢氟酸反应生成四氟化硅和水;
(2)NO2与一定量的O2混合通入水中生成硝酸,利用得失电子守恒找出NO2与一定量的O2的物质的量之比;
(3)PbO2中的Pb为+4价,具有强氧化性,PbO2与浓盐酸混合加热生成Cl2、PbCl2和H2O;
(4)SO2气体与溴水发生氧化还原反应,生成硫酸和溴化氢;
(5)脱硝过程中,NaClO2将NO氧化成NO3-、NO2-,NaClO2中+3价Cl被还原为Cl-。
(1)玻璃中含有SiO2,能与HF反应,该反应的化学方程式为SiO2+4HF=SiF4↑+2H2O;(2)NO2、O2和H2O完全反应生成HNO3,该反应的离子方程式为4NO2+O2+2H2O=4H++4NO3-;
(3)PbO2与浓盐酸混合加热生成Cl2、PbCl2和H2O,反应的离子方程式为PbO2+4HCl ![]() PbCl2+Cl2↑+2H2O;
PbCl2+Cl2↑+2H2O;
(4)SO2具有还原性,溴水具有氧化性,二者可发生氧化还原反应,该反应的离子方程式为SO2+Br2+2H2O=4H++2Br-+SO42-;
(5)脱硝过程中,将NO氧化成NO3-、NO2-,NaClO2中+3价Cl被还原为Cl-,由表中可以看到,NO主要被氧化成NO3-、该反应的离子方程式为:3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.通过丁达尔效应可以区分蔗糖溶液和蛋白质溶液
B.用![]() 等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染”
等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染”
C.干燥的氯气能使品红溶液褪色
D.3D打印技术以钛合金粉末为原料,通过激光熔化逐层堆积,来制造精密的钛合金结构件,高温时可用金属钠还原相应的氯化物溶液来制取金属钛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2mol·L-1H2C2O4溶液中滴加0.2mol·L-1NaOH溶液,有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水]。根据图示,下列说法不正确的是( )
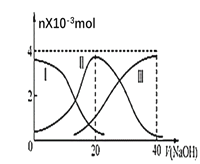
A.曲线Ⅱ代表的粒子是HC2O4-
B.当V(NaOH)=20mL时,溶液中离子浓度的大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-)
C.NaHC2O4溶液:c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4)
D.向NaHC2O4溶液中逐渐加入CaCl2粉末并充分搅拌,溶液pH可能逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl-
B.氯气溶于水:Cl2+H2O ![]() H++CI-+HClO
H++CI-+HClO
C.次氯酸钙中通二氧化硫:SO2+Ca2++H2O+2ClO-=CaSO3↓+2HClO
D.水玻璃(硅酸钠水溶液)中滴加醋酸:SiO32-+2H+=H2SiO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究矿物固体X(仅含4种短周期元素)的组成和性质,其中固体乙可制作光导纤维。现完成如下实验:
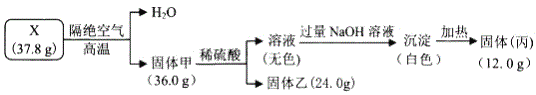
请回答:
(1)X的化学式为_____。
(2)X中所含的一种金属元素是___填元素符号),其单质在![]() 中燃烧的化学方程式为_____。
中燃烧的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京市场销售的某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
____KIO3+___KI+___H2SO4=___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是_________________________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是______________________。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是______________________。
②b中反应所产生的I2的物质的量是___________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
_______________________mg/kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东汉晚期的青铜奔马(马踏飞燕)充分体现了我国光辉灿烂的古代科技,已成为我国的旅游标志。下列说法错误的是

A.青铜是我国使用最早的合金、含铜、锡、铅等元素
B.青铜的机械性能优良,硬度和熔点均高于纯铜
C.铜器皿表面的铜绿可用明矾溶液清洗
D.“曾青(![]() )得铁则化为铜”的过程发生了置换反应
)得铁则化为铜”的过程发生了置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质M是一种酰胺类局麻药,某研究小组以A、E两种烃为有机原料,按以下路线合成M

已知:①![]() ;②
;②![]() ;
;
③![]() 。
。
请回答:
(1)化合物G的结构简式为______。
(2)下列说法不正确的是_________。
A.A→B为氧化反应
B.化合物G能与浓盐酸反应形成盐
C.化合物H与NaOH溶液反应最多消耗2molNaOH
D.局麻药M的分子式为C14H20N2O
(3)写出D+G→H的化学方程式:____________。
(4)写出满足下列条件的化合物F的所有同分异构体的结构简式________。
ⅰ.能与FeCl3溶液发生显色反应
ⅱ.能发生银镜反应
ⅲ.苯环上只有两个取代基且苯环上只有2种不同环境的氢原子
(5)该小组成员还提出另一种合成M的方案:化合物C与二乙胺[HN(CH2CH3)2]反应制取化合物X,X与G经一步反应即可制得药物M。请设计以烃A为原料制备化合物X的合成路线___________________________(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列七种元素,试按下述所给的条件推断。
①A、B、C 是同一周期的金属元素,已知原子核外有 3 个电子层,A 的原子半径在所属周期中最大且原子半径:A>B>C。
②D、E 是非金属元素,它们跟氢气化合可生成气态氢化物 HD 和 HE;在室温时,D 的单质是液体,E 的单质是固体。
③F 在常温下是气体,性质稳定,是除氢气外最轻的气体。
④G 是除氢外原子半径最小的元素(不考虑稀有气体)。
(1)F 的元素符号是_________。A 的名称是_________;B 位于周期表中第_________周期_________族;C的原子结构示意图为__________。
(2)E单质的颜色是_________。
(3)A元素与D元素形成的化合物的电子式为_________。
(4) 用电子式表示 G与A形成化合物的过程 : _________。
(5)在上述七种元素中,最高价氧化物对应水化物的碱性最强的是__________(填化学式下同),气态氢化物最稳定的是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com