
| A.拉瓦锡 | B.阿伏加德罗 | C.门捷列夫 | D.道尔顿 |
科目:高中化学 来源:不详 题型:推断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸性:HClO4>H3PO4>H2SO4 | B.氢化物稳定性:H2S>HF>H2O |
| C.碱性:NaOH>Al(OH)3>Mg(OH)2 | D.氧化性:F2 > Cl2 > Br2 > I2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.最高正化合价:③>②>① | B.第一电离能:③>②>① |
| C.电负性:③>②>① | D.原子半径:③>②>① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同一主族元素的气态氢化物,其相对分子质量越大,对应的熔、沸点一定越高 |
| B.升高温度可加快反应速率,其主要原因是反应物分子能量增加,单位体积活化分子的数目增多,活化分子的百分数不变,使得有效碰撞次数增多 |
| C.若R2-离子和M+离子的电子层结构相同,则原子序数:R>M |
| D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的pH:NaA<NaB |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径: 丁 >丙>乙 |
| B.单质的还原性:丁>丙>甲 |
| C.甲,乙,丙的氧化物均为共价化和物 |
| D.乙,丙,丁的最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
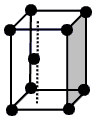
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com