
铅及其化合物工业生产及日常生活具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH=" a" kJ/mol
PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH=" b" kJ·mol-1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH=" c" kJ·mol-1
反应3PbS(s) + 6O2(g) = 3PbSO4(s) ΔH="kJ" ·mol-1(用含a,b ,c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g)  Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
| 温度 | 300 | 727 | 1227 |
| lgK | 6.17 | 2.87 | 1.24 |



(1)2a+2b-3c
(2)①<; ②9.09%
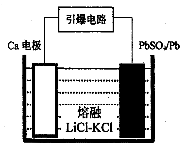
(3)PbSO4 + 2e-= SO42-+ Pb(或PbSO4 +Ca2++ 2e-= CaSO4+ Pb)
(4)4×10-9
(5)①Pb2+ + H2O Pb(OH)+ + H+ ②Pb2+
Pb(OH)+ + H+ ②Pb2+
解析试题分析:(1)依据盖斯定律,将前两式分别乘2,减去最后一式乘3,即可得所求反应的?H。(2)①lgK与K为增函数关系,从表中数据知,温度越高,K越小,说明正反应放热。②lgK=1,得K=10。设开始时通入CO为amol/L,达平衡时转化了x mol/L,则平衡时,CO为(x-a)mol/L,CO2为x mol/L,由K=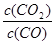 =
=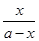 =10,解得
=10,解得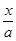 =9.09%。(3)由电池的装置图分析知,Ca作为负极,失去电子。则另一极为正极,得电子,化合价降低,即由PbSO4转化为Pb。(4)滴定过程中消耗的OH-,即为阳离子交换出来的H+,n(H+)=0.0025×20×10-3,c(H+)=n(H+)/25×10-3=2×10-3 mol/L,而C(H+)=C(I-),由PbI2的化学式知,C(Pb2+)= C(I-)/2=10-3 mol/L,Ksp(PbI2)=c(Pb2+)c2(I-)= 10-3×(2×10-3)2=4×10-9。(5)从左图分析,当pH由6变到7时,是Pb2+向Pb(OH)+转化,即为Pb2+水解,结合水电离出的一个OH-,同时释放出一个H+。从右图看,铅的去除率最高时,pH大约为6.5左右,对比左图知,在pH=6.5时,铅主要以Pb2+存在。
=9.09%。(3)由电池的装置图分析知,Ca作为负极,失去电子。则另一极为正极,得电子,化合价降低,即由PbSO4转化为Pb。(4)滴定过程中消耗的OH-,即为阳离子交换出来的H+,n(H+)=0.0025×20×10-3,c(H+)=n(H+)/25×10-3=2×10-3 mol/L,而C(H+)=C(I-),由PbI2的化学式知,C(Pb2+)= C(I-)/2=10-3 mol/L,Ksp(PbI2)=c(Pb2+)c2(I-)= 10-3×(2×10-3)2=4×10-9。(5)从左图分析,当pH由6变到7时,是Pb2+向Pb(OH)+转化,即为Pb2+水解,结合水电离出的一个OH-,同时释放出一个H+。从右图看,铅的去除率最高时,pH大约为6.5左右,对比左图知,在pH=6.5时,铅主要以Pb2+存在。
考点:化学反应速率与化学平衡、电解质溶液、中和滴定(氧化还原滴定)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为_________,2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为_________、_________。 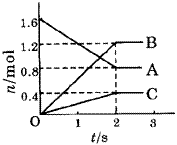
A、B、C三种物质的物质的量随时间变化的关系图
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如右图所示(实线)。图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol。
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如右图所示(实线)。图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol。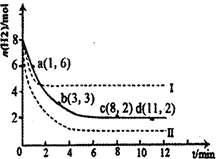
①下列时间段平均反应速率最大的是__________,最小的是______________。
| A.0~1min | B.1~3min | C.3~8min | D.8~11min |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g)  W (s) + 3H2O (g) 请回答下列问题:
W (s) + 3H2O (g) 请回答下列问题:
(1)在一定温度下进行上述反应,若反应容器的容积为0.5 L,2min后达到平衡,测得固体的质量减少了4.80 g,则H2的平均反应速率_________;该反应的平衡常数表达式K=___________
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为__________;随温度的升高,H2与水蒸气的体积比减小,则该反应为 ____(填“吸热”或“放热”) 反应。
(3)一定温度下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是________。
A.混合气体的总压强保持不变 B.v正(H20)= v正(H2)
C.混合气体的密度保持不变 D.混合气体的平均式量保持不变
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g) 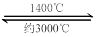 WI4 (g)。下列说法正确的有__________。
WI4 (g)。下列说法正确的有__________。
A.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.灯管内的I2可循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
科学家一直致力于“人工固氨”的新方法研究。目前合成氨技术原理为:N2(g) +3H2(g)  2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。
2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。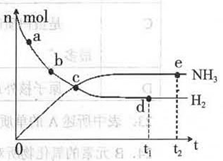
(1)下列叙述正确的是
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点e处的n (N2)相同
D.773K,30MPa 下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)在容积为2.0 L恒容得密闭容器中充入0.80 mol N2(g)和1.60 mol H2(g),673K、30MPa下达到平衡时,NH3的体积分数为20%。该条件下,N2(g)+3H2(g)  2NH3(g)的平衡常数值为:___。
2NH3(g)的平衡常数值为:___。
(3)K值越大,表明反应达到平衡时( )。
A. H2的转化率一定越高 B.NH3的产量一定越大
C.正反应进行得越完全 D.化学反应速率越大
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电解合成氨。其实验装置如图。阳极的电极反应为:H2-2e→2H+,则阴极的电极反应为:_____________。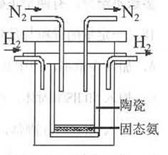
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用化学反应原理相关知识同答
I.根据下表所示化学反应与数据关系回答下列问题: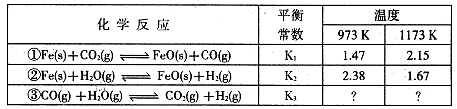
(1)反应①是 (填“吸热"或“放热”)反应。
(2)根据反应①与②可推导出同温下K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)若反应③的逆反应速率与时间的关系如图所示: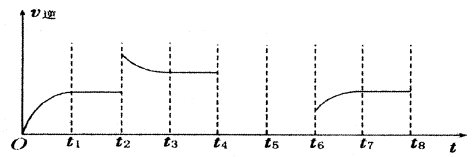
①反应在t1、t3、t7时都达到了平衡,若t2时只改变了一种外界条件j试判断:改变的条件可能是 。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。
II.请根据醋酸的电离平衡回答下列问题:
(1)常温下,0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子发生电离,则溶液的pH= 。
(2)将上述溶液加蒸馏水稀释,在稀释过程中,下列各项中增大的是 (填字母编号)。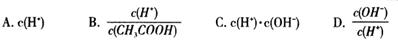
(3)25℃时,CH3COOH的电离平衡常数为1.75×10-5,现将一定量的CH3COOH与NaOH溶液混合,若测得混合液pH=5.6,则混合液中各离子浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法。该法的工艺流程为CrO42-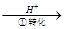 Cr2O72-
Cr2O72-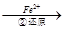 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42- (黄色)+2H+ Cr2O72- (橙色)+H2O
Cr2O72- (橙色)+H2O
(1)若平衡体系的pH=2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是__________。
a.Cr2O72-和CrO42-的浓度相同
b.2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(3)第②步中,还原1 mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
方法2:电解法。该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为__________________。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)_________________________________。溶液中同时生成的沉淀还有__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某温度时, 在一个0.5 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。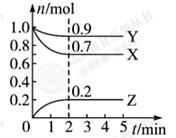
根据图中数据回答下列问题:
(1)该反应的化学方程式为 。
(2)反应开始至2 min,以气体Z表示的平均反应速率为 。
(3)用物质X表示的化学反应速率为0.2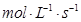 与用物质Y表示的化学反应速率为0.1
与用物质Y表示的化学反应速率为0.1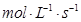 ,哪个快?( )
,哪个快?( )
a.前者 b.后者 c.一样快 d.无法比较
(4)若X、Y、Z均为气体,2 min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的 倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时 (填“增大”“减小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(8分)向200mL 6mol·L-1盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示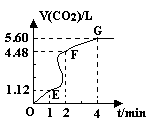 (气体体积均在标准状况下测定)。请回答下列问题:
(气体体积均在标准状况下测定)。请回答下列问题:
(1)设OE段的反应速率为v1,EF段的反应速率为v2,
FG段的反应速率为v3,则 影响v1、v2、v3反应速率的因素是 ;
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是 (填字母)
| A.蒸馏水 | B.氯化钾固体 | C.氯化钠溶液 | D.浓盐酸 |
 (3)加入CaCO3的质量为 。
(3)加入CaCO3的质量为 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com