
| A. | 用氨水吸收少量SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | 碳酸氢镁溶液中加入过量石灰水Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O | |
| C. | 澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| D. | 苯酚钠溶液中通入少量二氧化碳:CO2+H2O+2C6H5O-→2C6H5OH+CO32- |
分析 A.二者反应生成亚硫酸铵;
B.不符合反应客观事实,氢氧化钙过量,反应生成为氢氧化镁、碳酸钙和水;
C.澄清石灰水中氢氧化钙应拆成离子形式;
D.不符合反应客观事实,二者反应生成碳酸氢钠和苯酚
解答 解:A.二者反应生成亚硫酸铵,离子方程式:2NH3•H2O+SO2═2NH4++SO32-+H2O,故A正确;
B.碳酸氢镁溶液中加过量澄清石灰水,反应的离子方程式为:Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+2H2O+Mg(OH)2↓,故B错误;
C.澄清的石灰水与稀盐酸反应,离子方程式:OH-+H+═Ca2++H2O,故C错误;
D.苯酚钠溶液中通入少量二氧化碳,离子方程式:CO2+H2O+C6H5O-→C6H5OH+HCO3-,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实,遵循原子个数、电荷数守恒规律,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 充电时阳极反应:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| B. | 充电过程是电能转化为化学能的过程 | |
| C. | 放电时负极附近溶液的碱性不变 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据是否含有氧元素,将物质分为氧化剂和还原剂 | |
| B. | 根据是否具有丁达尔现象,将分散系分为溶液、胶体和浊液 | |
| C. | 根据水溶液是否能够导电,将物质分为电解质和非电解质 | |
| D. | 根据反应前后是否有元素化合价变化,可将化学反应分为氧化还原反应和非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=12的溶液中:AlO2-、Na+、SO42-、SO32- | |
| B. | 水电离出的c(H+)=1×10-12 mol•L-1的溶液中:K+、Na+、SO42-、AlO2- | |
| C. | 加入甲基橙呈黄色的溶液:NH4+、Fe2+、Cl-、NO3- | |
| D. | c(H+)=0.10 mol•L-1的溶液中:CH3COO-、NH4+、Cl-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,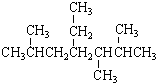 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,邻二甲苯、间二甲苯、对二甲苯的沸点依次增大 | |
| C. | 已知1mol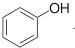 可以与1molNaOH发生反应.则1mol 可以与1molNaOH发生反应.则1mol 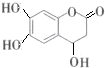 与足量的NaOH溶液发生反应时,需消耗4molNaOH 与足量的NaOH溶液发生反应时,需消耗4molNaOH | |
| D. | 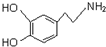 属于氨基酸,既能与强酸反应,又能与强碱反应 属于氨基酸,既能与强酸反应,又能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③ | C. | ②③ | D. | ② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com