
 为原料制取
为原料制取 ,是化工生产环已酮的基本原理,根据下列合成路线如下空:
,是化工生产环已酮的基本原理,根据下列合成路线如下空: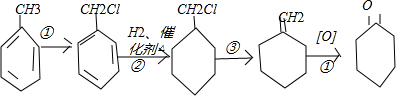
 ,
, 与氢气发生加成反应生成
与氢气发生加成反应生成 ,
, 在氢氧化钠醇溶液中发生消去反应生成
在氢氧化钠醇溶液中发生消去反应生成 ,
, 发生氧化反应生成
发生氧化反应生成 ,据此答题;
,据此答题; ,
, 与氢气发生加成反应生成
与氢气发生加成反应生成 ,
, 在氢氧化钠醇溶液中加热发生消去反应生成
在氢氧化钠醇溶液中加热发生消去反应生成 ,
, 发生氧化反应生成
发生氧化反应生成 ,
, +3H2
+3H2| 催化剂 |
 ,是加成反应;
,是加成反应; +NaOH
+NaOH| 醇 |
| △ |
 +NaCl+H2O,是消去反应;
+NaCl+H2O,是消去反应; +3O2
+3O2| 催化剂 |
 +2CO2+2H2O,是氧化反应,
+2CO2+2H2O,是氧化反应, +3H2
+3H2| 催化剂 |
 ,加成反应;
,加成反应; +NaOH
+NaOH| 醇 |
| △ |
 +NaCl+H2O,消去反应;2
+NaCl+H2O,消去反应;2 +3O2
+3O2| 催化剂 |
 +2CO2+2H2O,氧化反应;
+2CO2+2H2O,氧化反应;


科目:高中化学 来源: 题型:
| 元素A | 元素B | 元素C | 元素X | 元素Y |
| 单质是一种常见金属,与元素X形成黑色和红棕色三种常见化合物 | 基态原子M层p轨道上有5个电子 | 短周期中金属性最强,与X反应能生成两种常见化合物 | 最外层电子数是内层电子数的3倍,能形成双原子阴离子 | 单质为双原子分子,结构中σ键与π数目比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为了保护水资源,禁止使用化肥 |
| B、用电解大量水的方法获得清洁能源氧气 |
| C、4℃时,纯水的pH=7 |
| D、城市浇花,采用喷灌、滴滴灌技术 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 现象或事实 | 解释 |
| A | 明矾用于净水 | 铝离子水解产生的胶体具有很强吸附杂质的作用 |
| B | SO2能使溴水溶液褪色 | SO2具有还原性 |
| C | “地沟油”禁止食用,但可以用来制造肥皂 | “地沟油”主要成分为油脂属于酯类可以发生皂化反应 |
| D | 用氯水和淀粉溶液鉴别食盐是否加碘 | 目前加碘食盐中含碘元素物质为KI |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com