
【题目】用标准氢氧化钠溶液(浓度为0.2812mol/L)测定未知浓度的盐酸溶液。
(1)写出化学方程式:____________
(2)滴定时可用_________作指示剂,当溶液由___色变成___色,且0.5min不褪时达到滴定终点。
(3)取20.00mL待测盐酸溶液,滴定终点时,消耗标准氢氧化钠30.00mL,待测盐酸溶液的浓度为________
【答案】NaOH+HCl=NaCl+H2O 酚酞 无 粉红 0.4218 mol/L
【解析】
(1)氢氧化钠与盐酸反应生成氯化钠和水;
(2)强碱滴定强酸,反应后呈中性,可用酚酞为指示剂,滴定终点,溶液颜色由无色变为浅红色;
(3)酸碱恰好完全反应,满足c(酸)V(酸)=c(碱)V(碱),以此计算。
(1)氢氧化钠与盐酸反应生成氯化钠和水,化学方程式为:NaOH+HCl=NaCl+H2O;
(2)氢氧化钠滴定盐酸,根据滴定终点氢氧化钠的显色用酚酞较合适,酸碱恰好中和时,溶液颜色由无色变为浅红色,且0.5min不褪时证明达到滴定终点;
(3)根据c(酸)V(酸)=c(碱)V(碱),c(酸)=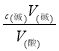 =
=![]() =0.4218 mol/L。
=0.4218 mol/L。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】据预测,到2040年我国煤炭消费仍将占能源结构的三分之一左右。H2S在催化活性碳(AC)表面的迁移,对煤的清洁和综合应用起了很大的促进作用,其机理如图所示,其中ad表示物种的吸附状态。下列有关叙述错误的是
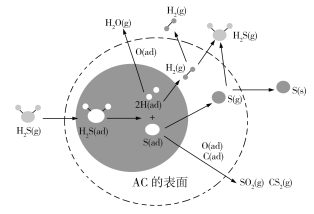
A. 图中阴影部分表示H2S分子的吸附与离解
B. AC表面作用的温度不同,H2S的去除率不同
C. H2S在AC表面作用生成的产物有H2O、H2、S、SO2、CS2等
D. 图中反应过程中只有H—S键的断裂,没有H—S键的形成
查看答案和解析>>
科目:高中化学 来源: 题型:
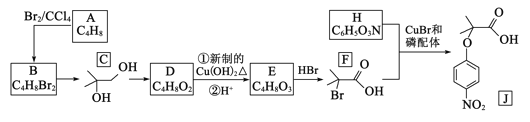
【题目】有机物J属于大位阻醚系列中的一种物质,在有机化工领域具有十分重要的价值.2018年我国首次使用α-溴代羰基化合物合成大位阻醚J,其合成路线如下:
已知: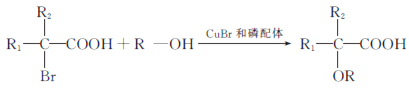
回答下列问题:
(1)A 的名称___________________.
(2)C →D的化学方程式_________________________.E →F的反应类型____
(3)H 中含有的官能团________________.J的分子式_______________.
(4)化合物X是D的同分异构体,其中能与氢氧化钠溶液反应的X有_____________种(不考虑立体异构),写出其中核磁共振氢谱有3组峰,峰面积之比为1∶1∶6的结构简式为___________________________.
(5)参照题中合成路线图。涉及以甲苯和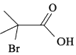 为原料来合成另一种大位阻醚
为原料来合成另一种大位阻醚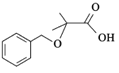 的合成路线:__________________。
的合成路线:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯乙醛(CCl3CHO)是生产农药、医药的重要中间体,实验室制备三氯乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
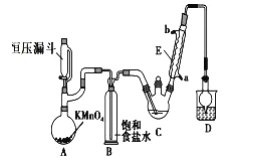
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
②相关物质的相对分子质量及部分物理性质:
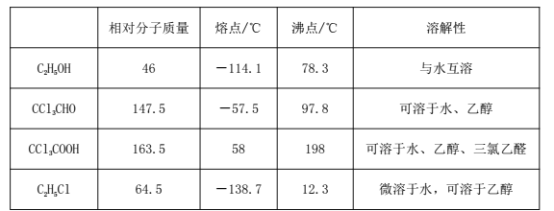
(1)恒压漏斗中盛放的试剂的名称是_____,盛放KMnO4仪器的名称是_____。
(2)反应过程中C2H5OH和HCl可能会生成副产物C2H5Cl,同时CCl3CHO(三氯乙醛)也能被次氯酸继续氧化生成CCl3COOH(三氯乙酸),写出三氯乙醛被次氯酸氧化生成三氯乙酸的化学方程式______。
(3)该设计流程中存在一处缺陷是______,导致引起的后果是______,装置B的作用是____。
(4)反应结束后,有人提出先将C中的混合物冷却到室温,再用分液的方法分离出三氯乙酸。你认为此方案是否可行____(填是或否),原因是______。
(5)测定产品纯度:称取产品0.36g配成待测溶液,加入0.1000molL 1碘标准溶液 20.00mL,再加适量Na2CO3溶液,反应完全后加盐酸调溶液pH,立即用0.02000molL 1Na2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液20.00mL。则产品的纯度为_____(计算结果保留四位有效数字)。滴定原理:CCl3CHO+OH-=CHCl3+HCOO-、HCOO-+I2=H++2I-+CO2、I2+2S2O32-=2I-+S4O62-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质之间的变化体现了化学之美。
(1)一定条件下,含氮元素的物质可发生如图所示的循环转化。
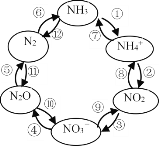
Ⅰ.图中属于“氮的固定”的是_______(填序号,下同);转化过程中发生非氧化还原反应的是_______________。
Ⅱ.反应④是在酸性条件下由NO3-与镁作用实现,则该反应的离子方程式为_______。
(2)H2S气体与CuCl2、FeCl3溶液发生一系列反应如图所示:
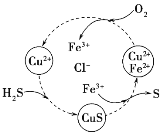
①转化图中化合价不变的元素是__________(写名称)。
②转化图中生成S单质的离子方程式为____________。
(3)A、B、C、D、E、F、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
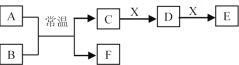
①若A为常见的金属单质,焰色反应呈黄色,B常温下为液态,X能使品红溶液褪色,则C和E反应的离子方程式为________。
②若D为两性氢氧化物,F为非金属单质,则X成分可能为____(写化学式,下同)。
③若A为红棕色气体,X为金属单质,溶液D中加入KSCN溶液变红。则E为______,F为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,能达到相应实验目的的是
|
|
|
|
A.制备并收集乙酸乙酯 | B.证明氯化银溶解度大于硫化银 | C.验证溴乙烷的消去产物是乙烯 | D.推断S、C、Si的非金属性强弱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的化工原料,以乙烯为原料在不同条件下可合成下列物质(部分条件未标出):乙烯![]() A
A![]() 乙醇
乙醇![]() 乙醛
乙醛![]() 乙酸。按下列要求写出:
乙酸。按下列要求写出:
(1)乙醇中含氧官能团名称为________,乙酸中含氧官能团名称为________
(2)写出下列反应方程式:
反应:____________
反应④:____________
(3)反应④的实验现象为:___________。实验室常用银氨溶液检验乙醛,所需用的实试剂2%硝酸银溶液和2%稀氨水;银氨溶液配制的方法是:______
(4)反应为乙醇与氧气在加热及Cu催化条件下反应生成乙醛,依次写出反应中铜丝由红变黑,再由黑变红过程中的化学方程式:__________、_______。
(5)若用如图所示装置试管a中收集乙醇催化氧化的产物:
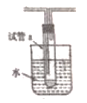
①水浴的作用为_______________,用姿色石蕊试纸检验收集的产物,试纸显红色,说明液体中还含有__________。
②要除去该物质,可在混合液中加入______(填写字母)
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过________(填实验操作名称)即可除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是元素周期表的一部分,回答下列有关问题:
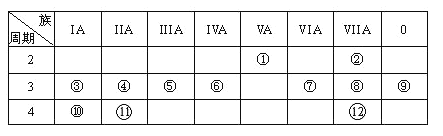
(1)写出元素⑥的元素符号:__________,元素⑦离子的电子式__________。
(2)画出元素④的原子结构示意图:________________________。
(3)在这些元素中,最不活泼的元素是__________(写元素符号)。
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是___________,碱性最强的是_____________,呈两性的氢氧化物是_______________。(以上均要求写化学式)
(5)推测50号元素在周期表中的位置:_________________________________。
(6)元素周期表中,元素性质与它们所形成的单质和化合物的性质均有周期性变化规律,试写出一条第三周期元素所形成的化合物某种性质的变化规律:__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com