
| 编 号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
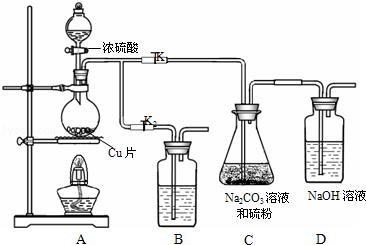
分析 在加热条件下,铜和浓硫酸发生氧化还原反应生成二氧化硫,所以A中发生的反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;打开K1,关闭K2,在C中Na2CO3和S、SO2反应生成Na2S2O3,Na2S2O3溶液具有弱碱性和较强的还原性,所以酸性条件下不能存在,二氧化硫不能完全反应且二氧化硫有毒,会污染空气,所以用NaOH吸收未反应的SO2;C中溶液的pH接近7时即停止C中的反应,打开K2,关闭K1,二氧化硫有毒,应该用B中溶液吸收二氧化硫,二氧化硫属于酸性氧化物,且有还原性,所以可以碱性物质或氧化性物质吸收二氧化硫;
(1)装置B的作用是吸收二氧化硫,二氧化硫具有还原性且是酸性氧化物,可以用碱性物质或氧化性物质吸收二氧化硫;
Na2S2O3溶液具有弱碱性和较强的还原性,酸性条件下不能存在;
(2)向足量的新制氯水中滴加少量的Na2S2O3溶液,氯水颜色变浅,且溶液中有硫酸根离子生成,说明二者发生氧化还原反应,则氯气被还原生成氯离子;
(3)判断达到滴定终点的现象是滴入最后一滴Na2S2O3时,溶液蓝色消失且半分钟不变色;
BaCrO4用盐酸溶解转化为Cr2O2-7,由元素守恒及已知方程式可得关系式:2Ba2+~2BaCrO4~Cr2O72-~3I2~6Na2S2O3,结合消耗的Na2S2O3利用关系式计算溶液中n(Ba2+),进而计算c(Ba2+).
解答 解:在加热条件下,铜和浓硫酸发生氧化还原反应生成二氧化硫,所以A中发生的反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;打开K1,关闭K2,在C中Na2CO3和S、SO2反应生成Na2S2O3,Na2S2O3溶液具有弱碱性和较强的还原性,所以酸性条件下不能存在,二氧化硫不能完全反应且二氧化硫有毒,会污染空气,所以用NaOH吸收未反应的SO2;C中溶液的pH接近7时即停止C中的反应,打开K2,关闭K1,二氧化硫有毒,应该用B中溶液吸收二氧化硫,二氧化硫属于酸性氧化物,且有还原性,所以可以碱性物质或氧化性物质吸收二氧化硫;
(1)装置B的作用是吸收二氧化硫,二氧化硫具有还原性且是酸性氧化物,可以用碱性物质或氧化性物质吸收二氧化硫,NaOH具有碱性、酸性高锰酸钾溶液具有强氧化性,所以NaOH和酸性高锰酸钾溶液都能吸收二氧化硫,则B中物质是NaOH或酸性高锰酸钾溶液;
Na2S2O3溶液具有弱碱性和较强的还原性,酸性条件下不能存在,反应离子方程式为S2O32-+2H+═S↓+H2O+SO2↑,
故答案为:AC;S2O32-+2H+═S↓+H2O+SO2↑;
(2)向足量的新制氯水中滴加少量的Na2S2O3溶液,氯水颜色变浅,且溶液中有硫酸根离子生成,说明二者发生氧化还原反应,则氯气被还原生成氯离子,离子方程式为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,故答案为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
(3)判断达到滴定终点的现象是滴入最后一滴Na2S2O3时,溶液蓝色消失且半分钟不变色;
4号使用的溶液体积与其它几组相比偏差较大,所以舍去,使用溶液平均体积=$\frac{18.02+17.98+18.00}{3}$mL=0.018L;
由题意可知,BaCrO4用盐酸溶解转化为Cr2O72-,由元素守恒及已知方程式可得关系式:2Ba2+~2BaCrO4~Cr2O2-7~3I2~6Na2S2O3,消耗的Na2S2O3为0.018L×0.01mol/L,则n(Ba2+)=0.018L×0.01mol/L×$\frac{1}{3}$=0.00006mol,故溶液中c(Ba2+)=$\frac{1}{3}$$\frac{6×1{0}^{-5}mol}{0.025L}$=0.0024mol/L,
故答案为:当滴入最后一滴Na2S2O3时,溶液蓝色消失且半分钟不变色;0.0024mol/L.
点评 本题考查制备实验方案设计,为高频考点,涉及物质制备、物质的量的计算、离子方程式书写、基本操作等知识点,明确实验原理及物质性质是解本题关键,注意(3)题计算时4号要舍去,为易错点.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:填空题

 .D燃烧放出大量热量,有望成为二十一世纪的新能源,与“传统能源”相比,它具有便于储运,比较安全(写出两点)等更加优越的特点.
.D燃烧放出大量热量,有望成为二十一世纪的新能源,与“传统能源”相比,它具有便于储运,比较安全(写出两点)等更加优越的特点.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易溶盐不存在沉淀溶解平衡 | |
| B. | 可通过调节溶液pH或加入沉淀剂使某些金属离子沉淀 | |
| C. | 某离子在溶液中沉淀完全,则该离子在溶液中已不存在 | |
| D. | 一般,溶解度小的易转化成溶解度更小的,而溶解度更小的不能转化成溶解度小的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 说明甲醛是具有氧化性的气体 | B. | 反应中甲醛被还原 | ||
| C. | 最终酸性高锰酸钾溶液是红色 | D. | 最终酸性高锰酸钾溶液是无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2 CsCl CBr4 CF4 | B. | SiO2 CsCl CF4 CBr4 | ||
| C. | CsCl SiO2 CBr4 CF4 | D. | CF4 CBr4 CsCl SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
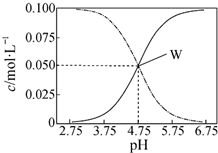
| A. | pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | W点表示溶液中:c(Na+)═c(CH3COO-)+c(CH3COOH) | |
| C. | pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol•L-1 | |
| D. | 向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)═c(CH3COOH)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com