
【题目】下列化合物中,只含离子键的是( )
A.HClB.CH4C.NaClD.NaOH
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】当人误食重金属盐类时,可以喝大量牛奶、蛋清或豆浆解毒。重金属盐使人中毒的原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最简式相同,但既不是同系物,又不是同分异构体的是
①辛烯和3-甲基-1-丁烯
②苯和乙炔
③1-氯丙烷和2—氯丙烷
④甲基环己烷和乙烯
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Al2(SO4)3溶液加热蒸干并灼烧最终得到物质是________________(填化学式),将NaHCO3与Al2(SO4)3两者溶液混合后可做泡沫灭火剂,其原理是_____________________(用离子方程式表示)
(2)实验室溶液中常用NaOH来进行洗气和提纯。当100mL 1mol·L-1的NaOH溶液吸收标准状况下2.24LSO2时,所得溶液中各离子浓度由大到小的顺序为____________________________
(3)25℃时,几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加NaOH溶液时,_____先沉淀(填离子符号),要使0.3mol·L-1硫酸铜溶液中Cu2+沉淀较为完全(当Cu2+浓度降至10-5 mol·L-1时),则应向溶液里加入氢氧化钠溶液使溶液pH为____(KspCu(OH)2=1×10-20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石油化工的一种产品A(乙烯)为主要原料合成一种具有果香味的物质E的生产流程如下:
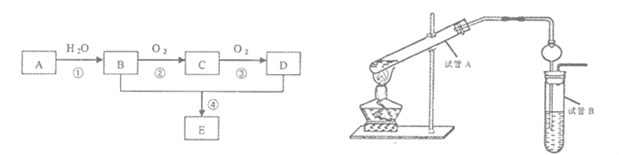
(1)写出步骤①的化学方程式_______________反应类型__________;
步骤②的化学方程式______________反应类型__________;
(2)某同学欲用上图装置制备物质E,回答以下问题:
①试管A发生反应的化学方程式_______________________;
②试管B中的试剂是______________________;分离出乙酸乙酯的实验操作是______________(填操作名称),用到的主要玻璃仪器为____________________;
③插入右边试管的导管接有一个球状物,其作用为_______________________。
(3)为了制备重要的有机原料——氯乙烷(CH3—CH2Cl),下面是两位同学设计的方案。
甲同学:选乙烷和适量氯气在光照条件下制备,原理是:
CH3—CH3+Cl2 ![]() CH3—CH2Cl+HCl
CH3—CH2Cl+HCl
乙同学:选乙烯和适量氯化氢在一定条件下制备,原理是:
CH2=CH2+HCl→CH3—CH2Cl
你认为上述两位同学的方案中,合理的是____,简述你的理由:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列表述错误的是( )
A.使用新能源,减少化石燃料的燃烧,可防止酸雨的产生
B.明矾在水中能形成胶体,可作为净水剂
C.建设三峡大坝使用了大量水泥,水泥是硅酸盐材料
D.给汽车安装尾气转化装置,易产生光化学烟雾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的前四周期元素,元素W是宇宙中最丰富的元素,元素X的原子最外层电子数是其内层的3倍,元素Z的基态原子核外电子有24种运动状态,Y、X、Z不在同一周期,且Y原子核外p电子比s电子多5个。
(1)Z基态原子的核外电子排布式为__________。
(2)Z的氧化物是石油化工中重要的催化剂之一,如催化异丙苯(![]() )裂化生成苯和丙烯。
)裂化生成苯和丙烯。
①1mol丙烯分子中含有σ键与π键数目之比为_______。
②苯分子中碳原子轨道的杂化类型为__________。
③Z的一种氧化物ZO5中,Z的化合价为+6,则其中过氧键的数目为_______个。
(3)W、X、Y三种元素的电负性由小到大顺序为__________。(请用元素符号回答)
(4)ZY3熔点为1152℃,熔融状态下能够导电,据此可判断ZY3晶体属于__________(填晶体类型)。
(5)ZX2晶体的晶胞结构如图,每个Z原子周围最近的X 原子数目为__________。若该化合物的相对分子质量为M,晶胞边长为acm,阿伏加德罗常数为NA,则该晶体的密度为_________g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50 mL 18 mol·L-1的H2SO4溶液中加入适量的铜片并加热。充分反应后,被还原的H2SO4的物质的量( )
A. 小于0.45 mol B. 等于0.45 mol
C. 在0.45~0.90 mol之间 D. 大于0.45 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.01mol某气体的质量为0.44g,该气体的摩尔质量为_______;在标准状况下,该气体的密度是_______
(2)0.3 mol氨气和0.4 mol二氧化碳的质量________(填“相等”或“不相等”,下同),所含分子数________,所含原子数________.
(3) 质量都是50 g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是________,在相同温度和相同压强条件下,体积最大的是________,体积最小的是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com