
| A. | AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| B. | 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+═I2+O2↑+2H2O | |
| C. | 在氢氧化钡溶液中滴加硫酸氢钾溶液至PH=7:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 用碳酸钠溶液浸泡锅炉水垢:Ca2++CO32-═CaCO3↓ |
分析 A.不符合反应客观事实;
B.双氧水和碘离子反应生成碘和水;
C.二者反应生成硫酸钡和硫酸钾和水;
D.水垢中含有的CaSO4,先用碳酸钠溶液处理,转化为 CaCO3.
解答 解:A.AlCl3溶液中加入过量氨水,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故A错误;
B.双氧水和碘离子反应生成碘和水,其离子方程式为2I-+H2O2+2H+═I2+2H2O,故B错误;
C.在氢氧化钡溶液中滴加硫酸氢钾溶液至PH=7,离子方程式:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故C正确;
D.水垢中含有的CaSO4,先用碳酸钠溶液处理,转化为 CaCO3,转化的离子方程式是CaSO4(s)+CO32- (aq)?CaCO3(s )+SO42- (aq),故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意沉淀转化的实质及离子方程式书写注意问题,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++SO32-+H2O→2Fe2++SO42-+2H+ | |
| B. | I2+SO32-+H2O→SO42-+2I-+2H+ | |
| C. | 2Fe2++I2→2Fe3++2I- | |
| D. | Br2+SO32-+H2O→SO42-+2Br-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验设计及操作 | 离子方程式 |
| Ⅰ.向盛有2mlCuSO4溶液的试管里加入2mlNaOH溶液,观察现象 | Cu2++2OH-═Cu(OH)2↓ |
| Ⅱ.向盛有2mL pH=1的HCl溶液的试管里慢慢滴入18mL(已足量)CH3COONH4溶液(查资料知CH3COONH4,溶液呈中性 )震荡摇匀,测得pH≈3.7 | |
| Ⅲ向盛有2mLNaHCO3溶液的试管里加入2mL H2SO4溶液,观察现象 | HCO${\;}_{3}^{-}$+H+═H2O+CO2↑ |
| Ⅳ向盛有2mL 稀Na2SO4溶液的试管里加入2mL稀KCl溶液,观察无明显现象 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 定样品中Na2O2的含量.
定样品中Na2O2的含量.
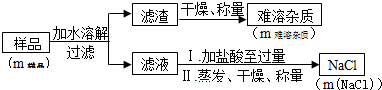
| m样品 | m难溶杂质 | m(NaCl) |
| 8.00g | 0.42g | 10.53g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1 mol•L-1的CuCl2溶液中含Cu2+为0.1NA | |
| B. | 标准状况下,22.4 L CCl4含CCl4分子为NA | |
| C. | 1mol H3O+含质子数为10 NA | |
| D. | 1mol Na2O2混合物中含阴离子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的颜色逐渐加深 | B. | 单质的熔沸点逐渐降低 | ||
| C. | 单质的密度逐渐减小 | D. | 单质在水中的溶解度逐渐增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com