
| A. | F | B. | N | C. | Na | D. | Al |
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 若反应开始时容器体积为2 L,则v(C)=0.4mol•L-1•min-1 | |
| B. | 若该反应在恒温恒容下进行,放出热量将增加 | |
| C. | 若2 min后,向容器中再投入等物质的量A、C,则B的转化率不变 | |
| D. | 若在恒压绝热条件下反应,平衡后n(C)<1.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
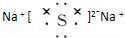 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应限度可衡量化学反应的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 可逆反应达到反应限度(化学平衡)时,正、逆反应速率相等 | |
| D. | 可以通过改变外界条件控制化学反应的限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率相等且都为零 | B. | 化学反应停止 | ||
| C. | 反应物和生成物共存 | D. | 反应物和生成物浓度均不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中有8个主族 | |
| B. | ⅠA族中的元素都是金属元素 | |
| C. | 第三周期有8种元素 | |
| D. | 短周期元素是指第一、二周期含有的全部元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制、铁制容器常温下可以盛放浓硫酸和浓硝酸 | |
| B. | 久置的浓硝酸呈黄色 | |
| C. | 硝酸电离出的H+能被Zn、Fe等金属还原成H2 | |
| D. | 浓硫酸是一种干燥剂,能够干燥Cl2、氧气等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质溶于水的过程中一定存在氧化还原反应 | |
| B. | Na2O2是离子化合物,该物质中含有共价键 | |
| C. | 氧化还原反应中的反应物若不是氧化剂则必然是还原剂 | |
| D. | 在化学反应中,氧化剂中的各元素都一定被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com