
| 选项 | 实验 | 现象 | 结论 |
| A | 将滴有酚酞的0.1mol•L-1氨水系稀释成0.01mol•L-1 | 溶液颜色变浅 | 稀释后NH3•H2O的电离程度减小 |
| B | 将铜粉加入1.0mol•L-1Fe2(SO4)3溶液中 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
| C | 用溴乙烷与NaOH乙醇溶液共热产生的气体通入酸性KMnO4溶液中 | 溶液褪色 | 产生的气体为乙烯 |
| D | 向1mL0.1mol•L-1 MgSO4溶液滴入2滴等浓度的NaOH溶液,片刻后再滴加2滴0.1mol•L-1 CuSO4溶液 | 先有白色沉淀生成,后变为蓝色沉淀 | Cu(OH)2的溶度积常数比Mg(OH)2的小 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.稀释促进弱电解质的电离,但电离出离子浓度减小;
B.Cu与Fe2(SO4)3反应生成FeSO4、CuSO4;
C.溴乙烷与NaOH乙醇溶液共热,发生消去反应生成乙烯,但乙醇易挥发,乙烯、乙醇均能被高锰酸钾氧化;
D.由现象可知发生沉淀的转化.
解答 解:A.稀释促进弱电解质的电离,但电离出离子浓度减小,溶液颜色变浅,NH3•H2O的电离程度增大,故A错误;
B.Cu与Fe2(SO4)3反应生成FeSO4、CuSO4,则不能有黑色固体出现,与结论无关,故B错误;
C.溴乙烷与NaOH乙醇溶液共热,发生消去反应生成乙烯,但乙醇易挥发,乙烯、乙醇均能被高锰酸钾氧化,则溶液褪色不能说明有乙烯生成,故C错误;
D.由现象可知发生沉淀的转化,则Cu(OH)2的溶度积常数比Mg(OH)2的小,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握弱电解质的电离、沉淀转化、有机物的性质、氧化还原反应为解答的关键,侧重分析与实验能力的考查,注意反应原理与实验的结合,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 碱性锌锰干电池属于二次电池 | B. | △H3=△H1+△H2 | ||
| C. | 反应①的活化能为24.4 kJ•mol-1 | D. | △H1<△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应 | 离子方程式 | 判断及改正方法 |
| A | CaCO3和醋酸溶液反应 | CaCO3+2H+═Ca2++H2O+CO2↑ | 正确 |
| B | 向Ba(OH)2溶液中加H2SO4溶液 | Ba2++OH-+H++SO42-═BaSO4↓+H2O | 错误:OH-、H+、H2O的化学计量数应均为2 |
| C | 过量的浓氨水加入到AlCl3溶液中 | Al3++3NH3•H2O═3NH4++Al(OH)3↓ | 错误:应生成AlO2-、NH4+、H2O |
| D | 将铜片插入硝酸银溶液中 | Cu+Ag+═Cu2++Ag | 正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③④⑤ | C. | ③④⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工厂排放 CO2会导致酸雨的形成 | |
| B. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| C. | “山东疫苗案”涉及疫苗未冷藏储运而失效,这与蛋白质变性有关 | |
| D. | 《黄白第十六》中有“曾青涂铁,铁赤如铜”,这与化学变化有关 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:填空题
O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)质量之和为96克的O2和O3的气体混合,其氧原子个数为______________。
(2)现要配制1 mol·L?1 Na2CO3溶液250 mL,求:①需要固体Na2CO3_____________g;②需要含结晶水的碳酸钠晶体(Na2CO3·10 H2O) g;③需要物质的量浓度为4 mol·L?1的Na2CO3溶液 mL;④需要溶质的质量分数为12%、密度为1.12 g·cm-3的Na2CO3溶液 mL。
(3)在配制上述溶液的过程中,可能导致配制溶液浓度偏小的有:_________
A. 固体Na2CO3放在右盘(1 g以下用游码);
B. 容量瓶用碳酸钠溶液先润洗;
C. 转移溶液时未洗涤烧杯;
D. 定容时,溶液未冷却;
E. 定容时视线仰视;
F. 摇匀时,发现液面低于容量瓶刻度线,但未补加水;
G. 容量瓶未干燥。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
如图锥形瓶中装满了c mol·L-1的Na2SO4溶液,经测定其中含有a mol SO42-,则锥形瓶容积为( )

A.a/c L B.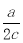 L C.ac L D.2ac L
L C.ac L D.2ac L
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳和碳的化合物在生产、生活中的应用非常广泛. 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),得到如下三组数据:
碳和碳的化合物在生产、生活中的应用非常广泛. 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| CO2 | H2 | CO | |||
| 1 | 800 | 4 | 2.5 | 1.5 | 5 |
| 2 | 830 | 2 | 2 | 1 | 3 |
| 3 | 830 | 2 | 2 | 1 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
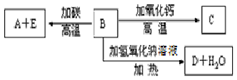 A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示.A为地壳中含量仅次于氧的非金属元素的单质.
A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示.A为地壳中含量仅次于氧的非金属元素的单质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com