

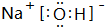 ,故答案为:离子键、共价键;
,故答案为:离子键、共价键;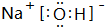 ;
;
| ||
| ||
| 3 |
| 2 |
| 3 |
| 2 |


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
| A、所有酸和碱之间的中和反应 |
| B、所有强酸和强碱之间的中和反应 |
| C、强酸溶液与强碱溶液生成可溶性盐和水的反应 |
| D、所有可溶性酸和可溶性碱之间的中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12.4g白磷(分子式为P4)中含有磷原子数为1.6NA |
| B、标准状况下,体积相等的CCl4和Cl2,前者含有的氯原子数是后者的两倍 |
| C、将饱和氯化铁溶液滴入沸水中,并继续煮沸至生成红褐色液体即可得到氢氧化铁胶体 |
| D、Cl2、SO2、NH3的水溶液都能够导电,因此都属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
| 1400℃ |
| 约3000℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 维生素C主要存在于蔬菜、水果中,它能增加人体对疾病的抵抗能力.其结构简式如图,请回答:
维生素C主要存在于蔬菜、水果中,它能增加人体对疾病的抵抗能力.其结构简式如图,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
2- 3 |
2- 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加压时(体积变小),将使正反应速率增大 |
| B、增大容器的体积,容器内气体的颜色变深 |
| C、保持体积不变,加入少许N2O4,再达平衡时,颜色变深 |
| D、保持体积不变,升高温度,再达平衡时颜色变深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com