

分析 不锈钢(主要成分为Fe)样品中含有铝、铜等,加入足量稀盐酸铁、铝溶解为氯化亚铁和氯化铜溶液,铜不溶解,过滤得到滤渣A为铜,滤液A中含有的溶质成分为FeCl2、AlCl3,通过氯气把氯化亚铁氧化为氯化铁得到溶液B中为FeCl3、AlCl3,B溶液中加入过量氢氧化钠溶液过滤,得到红褐色氢氧化铁沉淀和滤液C,滤液C中含有的溶质NaAlO2、NaCl、NaOH,红褐色沉淀氢氧化铁加热分解得到氧化铁,以此解答该题.
解答 解:不锈钢(主要成分为Fe)样品中含有铝、铜等,加入足量稀盐酸铁、铝溶解为氯化亚铁和氯化铝溶液,铜不溶解,过滤得到滤渣A为铜,滤液A中含有的溶质成分为FeCl2、AlCl3,通过氯气把氯化亚铁氧化为氯化铁,2FeCl2+Cl2=2FeCl3,得到溶液B中为FeCl3、AlCl3,B溶液中加入过量氢氧化钠溶液反应为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl,AlCl3+4NaOH=NaAlO2+3NaCl,过滤得到红褐色氢氧化铁沉淀和滤液C,滤液C中含有的溶质NaAlO2、NaCl、NaOH,红褐色沉淀氢氧化铁加热分解得到氧化铁;
(1)依据上述分析可知滤液C中含有的NaAlO2、NaCl、NaOH,故答案为:NaAlO2、NaCl、NaOH;
(2)反应②的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,滤液A中含有的溶质成分为FeCl2、AlCl3,验证滤液A中含Fe2+,而不含Fe3+,利用铁离子和亚铁离子的检验方法设计实验步骤分析,实验步骤为:取少量滤液A于试管中,滴几滴KSCN溶液,溶液不变色,再加氯水(或通氯气),溶液变为血红色,证明溶液中含有亚铁离子;
故答案为:2Fe2++Cl2=2Fe3++2Cl-;取少量滤液A于试管中,滴几滴KSCN溶液,溶液不变色,再加氯水(或通氯气),溶液变为血红色;
(3)样品质量为ag,所得Fe2O3固体称量得质量为b g,该样品中铁元素质量分数=$\frac{\frac{bg}{160g/mol}×2×56g/mol}{ag}$×100%=$\frac{7b}{10a}$×100%,故答案为:$\frac{7b}{10a}$×100%.
点评 本题考查混合物的分离和提纯,侧重考查分析计算能力,明确流程图中发生的反应及操作方法是解本题关键,知道各物质的成分,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
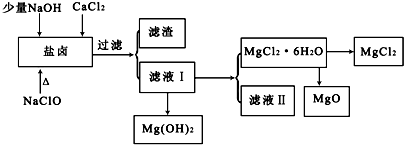
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加NH4Cl溶液 | B. | 加浓氨水 | C. | 加水稀释 | D. | 加NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气和二氧化硫都能使品红溶液褪色 | |
| B. | 异戊烷和异戊二烯都能使溴水层褪色 | |
| C. | 亚硫酸钠和乙烯都能使酸性高锰酸钾溶液褪色 | |
| D. | 活性炭与氢氧化钠溶液都能使二氧化氮气体褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 柠檬烯的分子式为C10H14 | |
| B. | 它的一氯代物有8种 | |
| C. | 它和丁基苯互为同分异构体 | |
| D. | 一定条件下,它分别可以发生加成、取代、氧化反应,但不能发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24 L CO2中含有原子数为0.3NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-为0.1NA | |
| C. | 一定条件下,4.6 g NO2和N2O4混合气体中含有的N原子数目为0.1NA | |
| D. | 1L0.1molL-1的氨水中有NA个NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com