
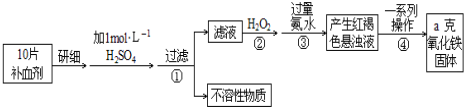
���� ������ͼ��֪����ʵ��ԭ��Ϊ����ҩƷ�е�Fe2+�γ���Һ����Fe2+����ΪFe3+��ʹFe3+ת��Ϊ����������������ת��Ϊ��������ͨ���ⶨ�����������������㲹Ѫ������Ԫ�صĺ�����
��1��˫��ˮ���������ԣ������������ܽ�Fe2+ȫ������ΪFe3+��������ͼ��֪������H2O2�ǽ�Fe2+����ΪFe3+��
��2��������ǽ�Fe3+ת��Ϊ��������������
��3���������һϵ�д�������������������Һ����ת��Ϊ����������Ҫ���ˡ�ϴ�ӵ�����������Ȼ��������������������ȴ�������������������
��4������һ�������1mol/L��ϡ���ᣬ����ʱ��Ҫ����������Ͳ���������ձ�����ͷ�ιܣ�����ƿ��
��5��������Ԫ���غ��֪ag����������Ԫ�ص�������Ϊ10Ƭ��Ѫ���������������ݴ˼��㣮
��� �⣺��1��˫��ˮ���������ԣ������������ܽ�Fe2+ȫ������ΪFe3+��
�ʴ�Ϊ����Fe2+ȫ������ΪFe3+��
��2��������ǽ�Fe3+ת��Ϊ����������������Ӧ���ӷ���ʽΪFe3++3NH3•H2O=Fe��OH��3��+3NH4+��
�ʴ�Ϊ��Fe3++3NH3•H2O=Fe��OH��3��+3NH4+��
��3���������һϵ�д�������������������Һ����ת��Ϊ����������Ҫ���ˡ�ϴ�ӵ�����������Ȼ��������������������ȴ�������������������
�ʴ�Ϊ�����ˣ����գ�
��4������һ�������1mol/L��ϡ���ᣬ����ʱ��Ҫ�������в���i�����ձ�����ͷ�ιܡ�250ml����ƿ����Ͳ��
�ʴ�Ϊ��250mL����ƿ����Ͳ������������ͷ�ιܣ�
��5��ag����������Ԫ�ص�������Ϊ10Ƭ��Ѫ������������������ÿƬ��Ѫ������Ԫ�ص�����$\frac{ag��\frac{112}{160}}{10}$��100%=0.07ag��
�ʴ�Ϊ��0.07a��
���� ���⿼��ѧ����ʵ��ԭ����ʵ����������⡢���ʷ����ᴿ��Ԫ�ػ��������ʡ���ѧ����ȣ��Ѷ��еȣ����ʵ��ԭ���ǽ���Ĺؼ�����Ҫѧ���߱���ʵ�Ļ���֪ʶ���ۺ�����֪ʶ�������⡢��������������


 ��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ba��OH��2 | B�� | NaOH | C�� | BaCl2 | D�� | AgNO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 35 | B�� | 37 | C�� | 36 | D�� | 35.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1NA������������ռ�����Ϊ22.4 L | |
| B�� | 2NA��������̼���ӵ�����Ϊ88 g | |
| C�� | 0.1 mol/L ��NaCl��Һ�У�Na+��Cl-��������Ϊ0.2NA | |
| D�� | 17 g NH3������ԭ����ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ | B�� | ������ | C�� | �˵���� | D�� | ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������Һ����һ������ˮ��Һ�У��μ�AgNO3������ǡ���ܽ� | |
| B�� | ����Cu��OH��2����Һ����һ����CuSO4��Һ�У���������NaOH��Һ | |
| C�� | 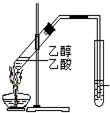 �Ʊ���������������ͼ��ʾ��ʵ��װ�� �Ʊ���������������ͼ��ʾ��ʵ��װ�� | |
| D�� | ����ϩ�ͱ�����������Ȼ�̼��Һ�ֱ�μӵ���������ϩ�ͱ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ���������ܶȲ��� | |
| B�� | �����ڵ���ѹǿ����ʱ��仯 | |
| C�� | �����и���ֵ������������ʱ��仯 | |
| D�� | ��λʱ��������2n mol��AB��ͬʱ����n mol��B2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2SeO4�������Ա�Cl2�� | B�� | SeO2�������Ա�SO2�� | ||
| C�� | H2SeO4�������Ա�H2SeO3ǿ | D�� | ŨH2SeO4�������Ա�HNO3ǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 H2AsO3-+OH�������ӷ���ʽ��ʾ��������Һ��c��H2AsO3-����c��AsO33-�������������������=������
H2AsO3-+OH�������ӷ���ʽ��ʾ��������Һ��c��H2AsO3-����c��AsO33-�������������������=������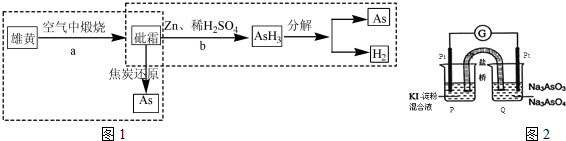
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com