
【题目】2020年1月9日,南京大学物理学院高力波教授团队,探索出了一种可控生长超平整石墨烯的方法,该方法有望推广到新材料、新能源等重要研究领域。
(1)如图图1和图2所示,科学家可以用特殊的胶带将石墨不断地粘撕得到石墨烯,是因为___。
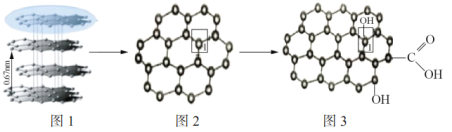
(2)石墨烯中碳原子的杂化方式为___,12g石墨烯中含有___个如图所示的六元环。
(3)石墨晶体中碳碳键的键长___金刚石晶体中碳碳键的键长(填“>”“<”或“=”),原因是___。
(4)如图图2和图3中,石墨烯转化为氧化石墨烯时,1号C与其相邻C原子间键能的变化是___(填“变大”、“变小”、“不变”)。
(5)曹原等研制得了具有超导特性的双层石墨烯新材料,手机一旦装上石墨烯电池,充电时间将被缩短为16分钟。将石墨烯逐层叠起来就是石墨,如图图4是石墨晶体的六方晶胞结构。

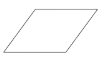
①在下列四边形内画出石墨晶胞沿c轴的投影___(用“”标出碳原子位置)。
②如果石墨晶胞中最近的两个碳原子之间的距离为apm,层间距为bpm,那么石墨晶体的密度为___ g·cm-3(列出计算式即可))。
【答案】石墨是层状较高,层与层之间是分子间作用力(范德华力) sp2 0.5NA < 石墨晶体中碳碳之间除σ键外还有大π键,金刚石晶体中碳碳之间只有σ键 变小 
![]()
【解析】
(1)石墨是层状结构,层与层之间通过分子间作用力;
(2)石墨烯中每个碳原子均和3个碳原子相连构成六圆环状结构;单层石墨烯中每个六元环含碳原子个数为6×![]() =2个;
=2个;
(3)石墨晶体中的碳碳键除σ键外还有大π键,金刚石中碳原子以sp3杂化形成四条杂化轨道,全部形成σ键;
(4)石墨烯转化为氧化石墨烯时,1号C连接的O原子吸引电子能力较强,导致与1号C原子相邻C原子对电子的吸引力减小;
(5)①根据投影,做出投影图;
②根据晶体密度计算公式ρ=![]() ,其中N为一个晶胞粒子数,M为一个原子的相对质量,V为一个晶胞的体积。
,其中N为一个晶胞粒子数,M为一个原子的相对质量,V为一个晶胞的体积。
(1)如图1所示,科学家可以用特殊的胶带将石墨不断地粘撕得到石墨烯,是因为石墨是层状结构,层与层之间通过分子间作用力结合,相对较弱;
(2)石墨烯中每个碳原子均和3个碳原子相连构成六圆环状结构,可知碳原子的杂化方式为sp2,单层石墨烯中每个六元环含碳原子个数为6×![]() =2个,12g石墨烯中含有NA个碳原子,则含
=2个,12g石墨烯中含有NA个碳原子,则含![]() =0.5NA个六元环;
=0.5NA个六元环;
(3)金刚石中碳原子以sp3杂化形成四条杂化轨道,全部形成σ键;石墨中碳原子以sp2杂化形成三条杂化轨道,还有一条未杂化的p轨道,所以石墨晶体中的碳碳键除σ键外还有大π键,所以石墨的C-C键的键长短;
(4)石墨烯转化为氧化石墨烯时,1号C连接的O原子吸引电子能力较强,导致与1号C原子相邻C原子对电子的吸引力减小,所以1号C与相邻C原子间键能变小;
(5)①晶胞沿c轴的投影,其中有两个C原子是重叠的影,投影为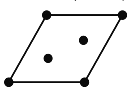 ;
;
②一个晶胞的体积为底面积×高,注意到,计算底面积时,题中CC键键长是指晶胞中层C以sp2杂化与其他C原子成键的键长,需要借助几何关系计算底面菱形中C与C之间的长度,记CC键键长为x,由余弦定理可得cos120°=![]() =-
=-![]() ,解得底面C与C之间的长度为x=
,解得底面C与C之间的长度为x=![]() apm,则一个晶胞底面积为S=(
apm,则一个晶胞底面积为S=(![]() apm )2sin120°=
apm )2sin120°=![]() a2pm2,因此一个晶胞的体积为V=Sh=
a2pm2,因此一个晶胞的体积为V=Sh=![]() a2b×2×1030cm3=
a2b×2×1030cm3=![]() a2b×1030 cm3,六方石墨晶胞中,8个顶点处的C原子为8个晶胞共有,竖棱上C原子为4个晶胞共有,面上C原子为2个晶胞共有,内部C原子为该晶胞所有,则每个晶胞中含有的C原子数为8×
a2b×1030 cm3,六方石墨晶胞中,8个顶点处的C原子为8个晶胞共有,竖棱上C原子为4个晶胞共有,面上C原子为2个晶胞共有,内部C原子为该晶胞所有,则每个晶胞中含有的C原子数为8×![]() +4×
+4×![]() +2×
+2×![]() +1=4,1mol晶胞含有4molC原子,则1mol晶胞的质量为m=4×12g,1mol晶胞含有NA个晶胞,则石墨晶体的密度为ρ=
+1=4,1mol晶胞含有4molC原子,则1mol晶胞的质量为m=4×12g,1mol晶胞含有NA个晶胞,则石墨晶体的密度为ρ=![]() =
=![]() g·cm-3。
g·cm-3。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】某温度下,弱酸H2A溶液中,存在H2A、HA-和A2-三种形态的粒子,其物质的量分数δ[δ(X)=![]() ]随溶液pH变化的关系如图所示,下列说法错误的是
]随溶液pH变化的关系如图所示,下列说法错误的是
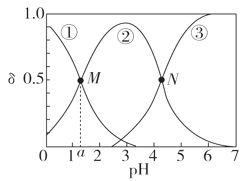
A.pH>4的溶液中,δ(A2-)=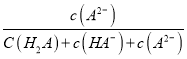 ,
,
B.M点对应的溶液中水的电离程度小于N点
C.若图中a为1.2,则lg [Ka1(H2A)]=-1.2
D.曲线②代表的粒子是HA-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于加成反应的是
A.CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
B.CH2=CH2+HCl![]() CH3CH2Cl
CH3CH2Cl
C.CH3CH2OH+CH3COOH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
D.2C6H6 + 15O2![]() 12CO2 +6H2O
12CO2 +6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应:N2(g) + 3 H2(g) ![]() 2NH3(g)。下列说法中,表明这一反应已经达到化学平衡状态的是( )
2NH3(g)。下列说法中,表明这一反应已经达到化学平衡状态的是( )
A.N2、H2、NH3的浓度不再变化
B.N2、H2、NH3的浓度相等
C.N2、H2、NH3在密闭容器中共存
D.反应停止,正、逆反应速率都等于零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A对氢气的相对密度为30,分子中含碳40%,含氢6.6%,其余为氧。
(1)通过计算确定该有机物的分子式;____
(2)按中学常见官能团,写出其可能的结构简式。____
查看答案和解析>>
科目:高中化学 来源: 题型:
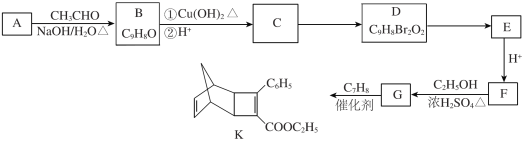
【题目】化合物K是有机光电材料中间体。由芳香族化合物A制备K的合成路线如下:
已知:![]()
![]()
回答下列问题:
(1)A的结构简式是________。
(2)C中官能团是________。
(3)D→E的反应类型是________。
(4)由F生成G的化学方程式是________。
(5)C7H8的结构简式是________。
(6)芳香族化合物X是G的同分异构体,该分子中除苯环外,不含其他环状结构,其苯环上只有1种化学环境的氢。X能与饱和碳酸氢钠溶液反应放出CO2,写出符合上述要求的X的结构简式:________。
(7)以环戊烷和烃Q为原料经四步反应制备化合物![]() ,写出有关物质的结构简式(其他无机试剂任选)。
,写出有关物质的结构简式(其他无机试剂任选)。![]() Q:____;中间产物1:________;中间产物2:____;中间产物3:________。
Q:____;中间产物1:________;中间产物2:____;中间产物3:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:
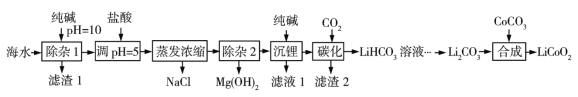
已知如下信息:①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
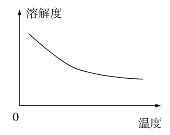
②碳酸锂的溶解度与温度关系如图所示。
③常温下,几种难溶物质的溶度积数据如下:
物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为____________ ,滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和____________________(填化学式)。
(2)调pH=5的目的是________________________。
(3) “沉锂”包括过滤、洗涤等,宜用_____________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
序号 | n(Na2CO3)/n(LiCl) | 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 0.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______________(填序号)方案投料。
(4) “除杂2”中调pH=13时c(Mg2)=_______________mol·L1。
(5) “合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2 mol SO2和1 mol O2充入一固定容积的密闭容器中,在催化剂作用下发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法中正确的是
2SO3(g) ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法中正确的是
A.SO2和SO3共2 mol
B.生成SO3 2 mol
C.放出197 kJ热量
D.含氧原子共12 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是
A. Fe3O4的物质的量不变 B. V(H2O)=V(H2)
C. 反应不再进行 D. 容器内压强不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com