
 为了探究氯气和氯水的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中,试回答:
为了探究氯气和氯水的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中,试回答:分析 浓盐酸和二氧化锰在加热条件下反应生成氯气,发生MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,可观察到C中湿润的紫色石蕊试纸先变红后褪色,D为尾气处理装置,应加入氢氧化钠溶液,以此解答该题.
解答 解:(1)检查装置的气密性的方法是:关闭分液漏斗,对烧瓶进行微热,看烧杯中是否有气泡产生,冷却后D中是否产生水柱,浓盐酸和二氧化锰在加热条件下反应生成氯气,发生MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:关闭分液漏斗,对烧瓶进行微热,看烧杯中是否有气泡产生,冷却后D中是否产生水柱;MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,可观察到C中湿润的紫色石蕊试纸先变红后褪色,故答案为:先变红后褪色;
(3)氯气可应用氢氧化钠来进行尾气处理,球形导管可以防止倒吸,故答案为:防倒吸;氢氧化钠溶液;尾气处理.
点评 本题综合考查氯气的制备、性质探究,为高考常见题型,侧重学生的分析、实验能力的考查,注意把握物质的性质以及实验的原理,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
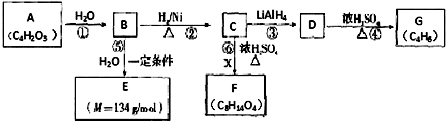
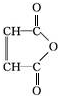 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
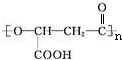
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe(NO3)2稀溶液中加入稀盐酸:Fe2++2H++NO3-═Fe3++NO2↑+H2O | |
| B. | 向NaHSO4溶液中加入过量的Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 向(NH4)2Mg(SO4)2溶液中加入少量的Na2O:Mg2++Na2O+H2O═Mg(OH)2↓+2Na+ | |
| D. | 向0.1mol•L-1、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-═A2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
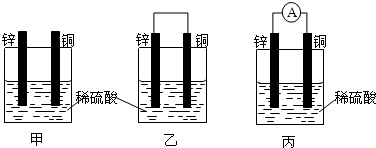
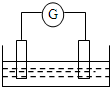 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 E的元素符号是Cl.
E的元素符号是Cl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 试运用所学知识,研究CO等气体的性质,请回答:
试运用所学知识,研究CO等气体的性质,请回答:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com