
| A. | 1:1:1 | B. | 2:3:2 | C. | 3:5:3 | D. | 4:3:3 |
分析 金属与醇反应,醇中-OH中的氢原子被还原生成氢气,根据H原子守恒可知,2n(-OH)=n(H2);标准状况下2.24L氢气的物质的量为0.1mol,0.1mol混合物与钠反应生成0.1mol氢气,说明混合物分子中平均含有2个羟基;乙二醇中含有两个羟基,其含量不影响生成氢气的量,只要乙醇与丙三醇中含有的羟基平均数为2即可.
解答 解:标准状况下2.24L氢气的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,0.1mol混合物与钠反应生成0.1mol氢气,
金属与醇反应,醇中-OH中的氢原子被还原生成氢气,根据H原子守恒可知,2n(-OH)=n(H2),说明混合物分子中平均含有2个羟基,
乙二醇中含有两个羟基,其含量不影响生成氢气的量,乙醇与丙三醇中含有的羟基平均数为2,则乙醇与丙三醇的物质的量之比为:1,
满足条件的为A、B、C,不满足条件的为D,
故选D.
点评 本题考查了混合物反应的计算,题目难度中等,明确羟基与氢气的关系式为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| 选项 | R | W | X | Y | Z | 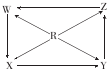 |
| A | Si | SiO2 | H2SiO2 | Na2SiO2 | SiCl4 | |
| B | Na | Na2O | Na2O2 | Na2CO3 | NaOH | |
| C | Fe | Fe(OH)2 | FeCl3 | FeCl3 | Fe(NO4)3 | |
| D | Al | NaAlO2 | Al2(SO4)3 | AlCl3 | Al(NO4)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为NaCl和酚酞和混合溶液浸湿的滤纸,离子交换膜只允许Na+通过,电池充电、放电的化学方程式为2Na2S2+NaBr3$\frac{\underline{\;放电\;}}{充电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )
如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为NaCl和酚酞和混合溶液浸湿的滤纸,离子交换膜只允许Na+通过,电池充电、放电的化学方程式为2Na2S2+NaBr3$\frac{\underline{\;放电\;}}{充电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )| A. | 电池充电时,电极B连接直流电源的正极 | |
| B. | 电池放电过程中Na+从左到右通过离子交换膜 | |
| C. | 闭合开关K后,b电极附近pH变小 | |
| D. | 当b电极上析出气体1120mL(标准状况)时,有0.1 molNa+通过离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、N2、NO、NO2 | B. | NO、NO2、N2O、N2O3 | ||
| C. | N2、N2O、NO2、N2O5 | D. | NH3、NO2、N2O4、HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2++SO42-═BaSO4↓ | |
| B. | 2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| C. | Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓ | |
| D. | Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能只有甲烷 | B. | 可能只有氢气 | ||
| C. | 可能是甲烷和一氧化碳 | D. | 可能3种气体都存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L Na2SO4溶液中,Na+的物质的量浓度为 0.1mol/L | |
| B. | “物质的量”是国际单位制中的一个基本单位 | |
| C. | 22.4L任何气体的物质的量均为1mol | |
| D. | 0.2mol由H2、O2、N2和CO2组成的混合气体在标准状况下的体积约为4.48L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com