
| A. | 漂白粉长期放置在空气中会被空气中的氧气氧化而变质 | |
| B. | 河水中有许多杂质和有害细菌,加入K2FeO4可以消毒杀菌除杂 | |
| C. | 辽宁舰上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| D. | 利用加热的方法杀死人体内感染的埃博拉病毒 |
分析 A.漂白粉长期放置在空气中,与水、二氧化碳反应;
B.K2FeO4具有强氧化性,还原产物为铁离子;
C.特种钢缆,为合金材料;
D.高温可使蛋白质发生变性.
解答 解:A.漂白粉长期放置在空气中,与水、二氧化碳反应,生成HClO光照分解,漂白粉与氧气不反应,故A错误;
B.K2FeO4具有强氧化性,可消毒杀菌,且还原产物水解生成胶体可吸附水中悬浮杂质,故B正确;
C.特种钢缆,为合金材料,不属于新型无机非金属材料,故C错误;
D.高温可使蛋白质发生变性,但不能利用加热的方法杀死人体内感染的埃博拉病毒,人体中蛋白质加热下发生变性,故D错误;
故选B.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意生活与化学的联系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 电解时阴极上无金属析出的溶液:Al3+、Zn2+、Cl-、SO42- | |
| B. | 加入铁粉有氢气生成的溶液:Mg2+、K+、NO3- | |
| C. | 通入SO2后无沉淀生成的溶液:Ba2+、Fe3+、Cl-、NO3- | |
| D. | 常温下,水电离出的c(H+)=1×10-12mol/L的溶液中:Cl-、I-、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度能加快反应速率 | |
| B. | 1mol N2和3mol H2的总能量低于2mol NH3的总能量 | |
| C. | 达到化学反应限度时,生成2molNH3 | |
| D. | 平衡时各组分含量之比一定等于3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
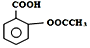 所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )
所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )| A. | 该化合物的分子式为C9H10O4 | |
| B. | 乙酰水杨酸的所有原子均在同一平面上 | |
| C. | 与乙酰水杨酸具有相同官能团,且苯环上只有两个取代基的芳香族同分异构体共有8种(不考虑立体异构) | |
| D. | 服用阿司匹林药量过大时,可出现精神错乱、惊厥甚至昏迷等水杨酸反应,可用小苏打溶液解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol甲醇中含有的共价键数为4 NA | |
| B. | 5.6g乙烯和环丁烷(C4H8)的混合气体中含的碳原子数为0.4 NA | |
| C. | 常温下,pH=2的盐酸溶液中含有的H+数目为0.02NA | |
| D. | 常温下,1L 0.5 mol/L的FeCl3溶液中,所含Fe3+数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚硝酸钠是重要的防腐剂.亚硝酸钠外观与食盐非常相似,毒性较强,所以必须加以区分.以下是常用的两种鉴别NaCl和NaNO2 的方法:
亚硝酸钠是重要的防腐剂.亚硝酸钠外观与食盐非常相似,毒性较强,所以必须加以区分.以下是常用的两种鉴别NaCl和NaNO2 的方法:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑥ | B. | ①②③④⑤ | C. | ①③④⑤⑥ | D. | ②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
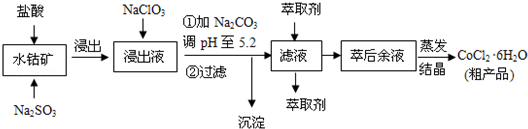
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com