
| A. | 黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了 | |
| B. | HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂 | |
| C. | 石油裂解和油脂皂化都有高分子生成小分子的过程 | |
| D. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
分析 A.乙醇可被氧化,乙酸具有酸性;
B.HNO3能与苯、甲苯、甘油、纤维素等有机物分别发生硝化反应、酯化反应;
C.油脂不是高分子化合物;
D.羟基、羧基、酯基都可发生取代反应,乙酸可与碳酸钠反应.
解答 解:A.乙醇具有还原性能够被氧化成乙酸,乙酸含有羧基,具有酸性,故A正确;
B.硝酸在浓硫酸催化条件下与苯、甲苯发生硝化反应,在浓硫酸催化条件下与甘油和纤维素发生酯化反应,故B正确;
C.高分子化合物的相对分子质量在10000以上,油脂不属于高分子,故C错误;
D.醇和酸的酯化反应,酯的水解反应都属于取代反应,饱和碳酸钠可以降低乙酸乙酯的溶解度,同时中和乙酸,故D正确.
故选C.
点评 本题考查较为综合,涉及有机物的组成、结构、性质以及应用,为高考常见题型和高频考点,侧重于学生的分析能力的考查,有利于培养学生良好的科学素养,难度不大.


科目:高中化学 来源: 题型:选择题
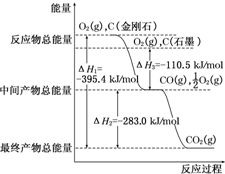
| A. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.6 kJ•molˉ1 | |
| B. | 2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ | |
| C. | 相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量 | |
| D. | 拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)家用液化气中主要成分之一是丁烷(C4H10).当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ.试写出丁烷燃烧反应的热化学方程式
(1)家用液化气中主要成分之一是丁烷(C4H10).当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ.试写出丁烷燃烧反应的热化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:解答题
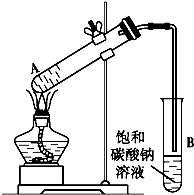 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如下图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如下图所示.| 乙酸 | 乙醇 | 乙酸乙酯 | C2H5OC2H5(乙醚) | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔和苯均为不饱和烃,都只能发生加成反应 | |
| B. | 加新制的Cu(OH)2悬浊液并加热可检验尿液中的葡萄糖 | |
| C. | 油脂在酸的催化作用下可发生水解,工业上利用该反应生产肥皂 | |
| D. | 可以用蛋白质的焰色反应,来鉴别部分蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
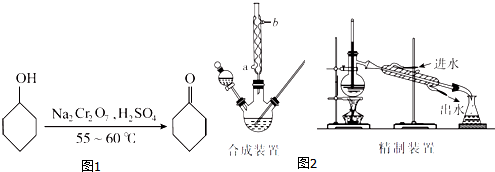
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 100 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 98 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 18 | 100.0 | 0.9982 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol | B. | 0.25 mol | C. | 0.35 mol | D. | 0.45 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
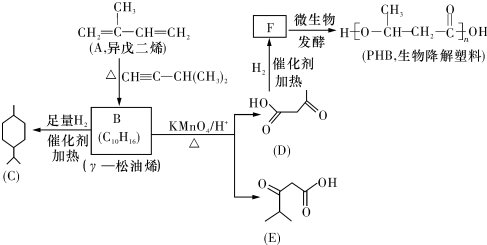
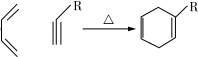
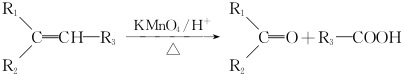
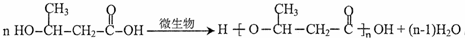 .
.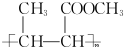 (一种类似有机玻璃的塑料).在催化剂作用下,第三步反应的化学方程式是
(一种类似有机玻璃的塑料).在催化剂作用下,第三步反应的化学方程式是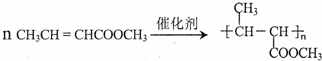 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com