
分析 ①金属腐蚀是金属原子失去电子;活泼性较强的作原电池的负极被腐蚀,活泼性较弱的金属作正极被保护;
②碳酸钙与二氧化硅反应生成硅酸钙和二氧化碳;根据橡胶硫化对分子结构的影响分析.
解答 解:①金属腐蚀的本质是金属原子失去电子被氧化;要保护金属铁,可以连接一种比金属铁活泼的金属,如金属锌,形成原电池,活泼性较强的作原电池的负极被腐蚀,活泼性较弱的金属作正极被保护;
故答案为:金属原子失去电子;锌块;
②在普通玻璃制造过程中,碳酸钙与二氧化硅在高温下发生反应生成硅酸钙和二氧化碳,其反应方程式为:CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑;天然橡胶通过硫化,使它的分子形成网状结构,从而增大橡胶的强度;
故答案为:CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑;网状.
点评 本题考查了金属的腐蚀、金属的电化学防护、硅酸盐工业、橡胶等,侧重于化学知识在生产生活中应用的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
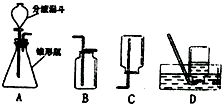 过氧化氢溶液在二氧化锰作催化剂的条件下能迅速分解,分液漏斗可以通过调节活塞控制液体的滴加速度,请根据图回答以下问题:
过氧化氢溶液在二氧化锰作催化剂的条件下能迅速分解,分液漏斗可以通过调节活塞控制液体的滴加速度,请根据图回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
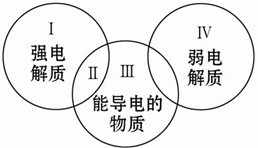 对下列物质:①镁 ②石墨 ③熔融氯化钠 ④盐酸 ⑤稀硫酸 ⑥氨水 ⑦白磷 ⑧硫酸钡 ⑨冰醋酸 ⑩二氧化碳,分类正确的是( )
对下列物质:①镁 ②石墨 ③熔融氯化钠 ④盐酸 ⑤稀硫酸 ⑥氨水 ⑦白磷 ⑧硫酸钡 ⑨冰醋酸 ⑩二氧化碳,分类正确的是( )| A. | Ⅰ包含的物质有③④⑤⑧ | B. | Ⅱ中包含的物质是③ | ||
| C. | Ⅲ中包含的物质是①②③⑤⑥⑧ | D. | Ⅳ中包含的物质是⑥⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能够提高化学反应速率 | B. | 能够提高产品的产量 | ||
| C. | 能够提高经济效益 | D. | 能够节约原料和能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 或
或 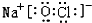 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(O2 )=0.01mol•L-1•s-1 | B. | V(NO )=0.08mol•L-1•s-1 | ||
| C. | V(H2O)=0.01mol•L-1•s-1 | D. | V(NH3)=0.002mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
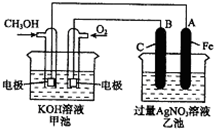 如图是一个化学过程的示意图.
如图是一个化学过程的示意图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com