
| A. | c(N2)=2.25 mol/L | B. | c(NH3)=1.9 mol/L | C. | c(H2)=0.3 mol/L | D. | c(N2)=1.3mol/L |
分析 化学平衡研究的对象为可逆反应.化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度,实际量小于极限值,据此计算.
解答 解:反应N2(g)+3H2(g)?2NH3(g)为可逆反应,转化率不可能为100%,根据化学计量数及极值法计算;
N2(g)+3H2(g)?2NH3(g)
1.5mol/L 0.6mol/L 1.5mol/L
正向进行:1.3mol/L 0mol/L 1.9mol/L
逆向进行:2.25mol/L 2.85mol/L 0mol/L
所以此反应达到平衡后c(N2)=(1.3~2.25)mol/L,c(H2)=(0~2.85)mol/L,c(NH3)=(0~1.9)mol/L,则ABD错误,C正确;
故选C.
点评 本题考查了可逆反应的特点,题目难度不大,转移明确可逆反应中反应物转化率不可能为100%,该题是高考中的常见题型,注重基础,侧重考查学生分析问题、解决问题的能力.


科目:高中化学 来源: 题型:解答题
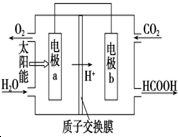 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途. | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
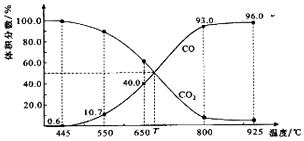
| A. | 550℃时,若充入惰性气体,v正、v逆均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0P总 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2都能与水反应生成相应的酸 | |
| B. | 硅可以用做半导体材料,SiO2可用于制光导纤维 | |
| C. | 氢氧化钠溶液保存在磨口玻璃塞的试剂瓶中 | |
| D. | 玻璃是人类最早使用的硅酸盐材料,玻璃加热熔化时有固定的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8 g D2O含有NA个中子 | |
| B. | 标准状况下,22.4 L己烷中共价键数目为19NA | |
| C. | 5.35 g NH4Cl固体中含有N-H键的个数为0.4NA | |
| D. | 常温下将0.1 mol Fe投入足量的浓硝酸中,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)用作橡胶工业的硫化剂S2Cl2的分子结构中每个原子均满足8电子稳定结构,①试写出S2Cl2的电子式
(1)用作橡胶工业的硫化剂S2Cl2的分子结构中每个原子均满足8电子稳定结构,①试写出S2Cl2的电子式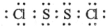 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com