


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
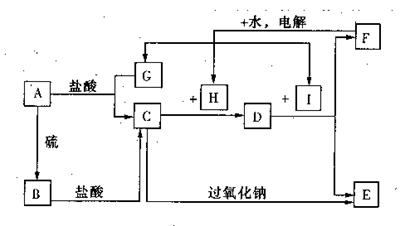
 采取的方法是 。
采取的方法是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
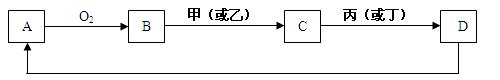
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 ;B ; H ;F
;B ; H ;F 
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe在Cl2中燃烧能生成FeCl3 |
| B.氯化氢气体与氨气相遇,有大量的白烟生成 |
| C.向蔗糖中加入浓硫酸,浓硫酸主要表现出脱水性和强氧化性 |
| D.过量的铜和少量的稀硝酸充分反应后,再加入一定量稀硫酸,剩余铜片的质量不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.存放W单质的仓库失火不能用CO2灭火 | B.Z的氧化物通常形成分子晶体 |
| C.Y的单质能把溴从溴化物中置换出来 | D.X的氢化物可以是两种液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com