
【题目】“84消毒液”(主要成分为NaClO)能有效杀灭新型冠状病毒,某化学小组对“84消毒液”的制备和性质进行研究。请回答下列问题:
I.甲同学查阅资料知道可以利用氯气与氢氧化钠溶液反应制取“84消毒液”,同时发现“在加热情况下卤素与碱液发生如下反应:3X2+6OH-→5X-+XO3-+3H2O”。由此设计了如下装置。
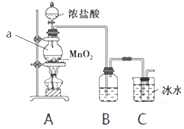
(1)仪器a的名称为__________,B中所用试剂为__________。
(2)A中发生反应的离子方程式为________。
(3)有同学认为该实验存在明显的缺陷,如何改进:________。
II.乙同学阅读某“84消毒液”的包装说明得到以下信息:
严禁与洁厕灵(主要成分盐酸)同时使用。
有效氯含量在5%以上。
有效氯含量用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征。
(1)“84消毒液”与洁厕灵同时使用会产生有毒的氯气,写出反应的离子方程式___。
(2)乙同学进行如下实验测定有效氯:
步骤一:取C中大试管溶液5 g于锥形瓶,加入20 mL 0.5 mol·L-1 KI溶液,10 mL 2 mol·L-1的硫酸溶液。
步骤二:用0.1000 mol·L-1 Na2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点时共用去20.00 mL Na2S2O3溶液。(I2+2S2O32-=2I-+S4O62-)
步骤一反应的离子方程式为________。通常选用__________作指示剂,滴定至终点的现象________。此消毒液有效氯含量为__________%(保留二位有效数字)。
【答案】圆底烧瓶 饱和食盐水 ![]() 在C装置后增加一个装有NaOH溶液的烧杯作为尾气处理装置
在C装置后增加一个装有NaOH溶液的烧杯作为尾气处理装置 ![]()
![]() 淀粉溶液 当加入最后一滴Na2S2O3溶液,溶液由蓝色变为无色,且半分钟不变色 1.4%
淀粉溶液 当加入最后一滴Na2S2O3溶液,溶液由蓝色变为无色,且半分钟不变色 1.4%
【解析】
装置A制备氯气,利用装置B除去氯气中的氯化氢,利用装置C制备次氯酸钠,结合物质的性质和问题分析解答。
I.(1)仪器a的名称为圆底烧瓶;实验室中利用浓盐酸与二氧化锰反应制取氯气,制取的氯气中含有杂质HCl,装置B用来除去杂质HCl,所用试剂为饱和食盐水。
(2)A中浓盐酸与二氧化锰发生反应,离子方程式为![]() 。
。
(3)氯气有毒,需要进行尾气处理,需要在C装置后增加一个装有NaOH溶液的烧杯作为尾气处理装置。
II. (1)“84消毒液”与洁厕灵同时使用会产生有毒的氯气,原因是NaClO与盐酸发生氧化还原反应,离子方程式为![]() 。
。
(2)步骤一中I-与试管C中的ClO-发生氧化还原反应,离子方程式为![]() 。碘单质遇淀粉显蓝色,故通常选用淀粉溶液作指示剂,滴定至终点的现象当加入最后一滴Na2S2O3溶液,溶液由蓝色变为无色,且半分钟不变色。根据步骤一、二反应方程式可知,n(ClO-)=n(I2)=
。碘单质遇淀粉显蓝色,故通常选用淀粉溶液作指示剂,滴定至终点的现象当加入最后一滴Na2S2O3溶液,溶液由蓝色变为无色,且半分钟不变色。根据步骤一、二反应方程式可知,n(ClO-)=n(I2)=![]() n(S2O32-)= 0.1000 mol·L-1×20.00 ×10-3L×
n(S2O32-)= 0.1000 mol·L-1×20.00 ×10-3L×![]() =0.001mol。有效氯含量用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征,因2H++ClO-+Cl-=Cl2↑+H2O,故此消毒液有效氯含量
=0.001mol。有效氯含量用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征,因2H++ClO-+Cl-=Cl2↑+H2O,故此消毒液有效氯含量![]() 。
。


科目:高中化学 来源: 题型:
【题目】如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,

下列说法错误的是
A. B极为原电池的正极
B. A、B、C可能分别为Zn、Cu、稀盐酸
C. C中阳离子向A极移动
D. A极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯是重要的化工原料,有关乙苯的转化关系如图所示。已知
CH3CH2Br+NaOH![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
CH3CH2Br+NaOH![]() CH2=CH2+NaBr+H2O
CH2=CH2+NaBr+H2O
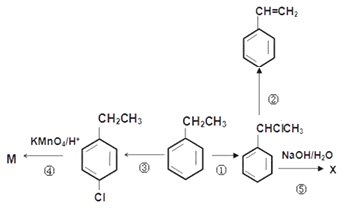
请回答下列问题:
(1)写出下列反应进行时的试剂与条件:反应②______________,反应③______________;
(2)写出下列反应的类型:反应①______________,④反应______________;
(3)写出下列物质的结构简式:M____________________
(4)②反应后的有机产物最多有多少碳原子共面______________
(5)写出下列反应的化学方程式:反应⑤________________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下刎有关实验装置、操作,不能实现相应实验目的的是

A. 装置甲可用酸性KMnO4溶液滴定FeSO4溶液
B. 用装置乙进行实验时若逐滴滴加AgNO3溶液先出现黄色沉淀,可说明 Ksp(AgCl)>Ksp(AgI)
C. 装置丙可用于收集氢气
D. 装置丁可用于 NaOH溶液除去溴苯中单质溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( )
①![]() ②
②![]() ③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤
③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A. ①③⑥B. ②③⑤C. ②④D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原法处理氮的氧化物是环境科学研究的热点课题。
I.氢气还原法。H2还原NO发生的反应为2NO(g)+2H2(g)![]() N2(g)+2H2O(g)。
N2(g)+2H2O(g)。
(1)已知几种化学键的键能数据如下:

2NO(g)+2H2(g)![]() N2(g)+2H2O(g) △H=__________kJ·mol-1
N2(g)+2H2O(g) △H=__________kJ·mol-1
(2)2NO(g)+2H2(g)![]() N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
反应1(反应慢):2NO(g)+H2(g)![]() N2(g)+H2O2(g);
N2(g)+H2O2(g);
反应2(反应快):H2O2(g)+H2(g)![]() 2H2O(g)
2H2O(g)
上述两步反应中,活化能较大的是反应__________(填“1”或“2”)。c(NO)对总反应速率的影响程度__________c(H2)(填“大于”“小于”或“等于”)。
II.NH3还原法。在恒容密闭容器中充入NH3和NO2;在一定温度下发生反应: 8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(g)
7N2(g)+12H2O(g)
(3)下列表明该反应达到平衡状态的是__________(填字母)。
A 混合气体密度保持不变 B NO2和N2的消耗速率之比为6:7
C 混合气体中c(N2)=c(NO2) D 混合气体压强保持不变
III.CO还原法。利用高效催化剂处理汽车尾气中的NO和CO,发生反应: 2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H。在2L恒容密闭容器中充入2 mol CO和2 mol NO,测得NO的转化率与温度、时间的关系如图所示。
N2(g)+2CO2(g) △H。在2L恒容密闭容器中充入2 mol CO和2 mol NO,测得NO的转化率与温度、时间的关系如图所示。
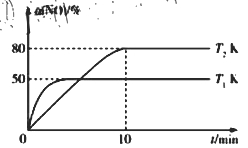
(4)下列说法正确的是_________(填字母)。
A 图像中,T1>T2 B 上述反应在高温下能自发进行
C 10min时,T2K下正、逆反应速率相等 D 增大NO的浓度,反应物的转化率增大
(5)T2K温度下,0-10min内用CO表示的平均反应速率v(CO)=_________mol/L-1·min-1;T1K温度下,上述反应的平衡常数K=_________L·mol-1。
(6)T1K温度下,向平衡后的容器内再加入2 mol N2和2 mol NO,则平衡_________(填“向右移动”“向左移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1-溴丙烷在不同条件下的反应及各物质转化关系如图所示:
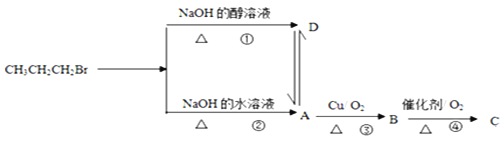
(1)D物质的结构简式为_____________,试写出反应②的化学反应方程式:________________。
(2)有机物A可以金属钠反应,试写出该反应的化学方程式_______________________________。
(3)B物质中可能含有的官能团是_________________。检验该官能团常用以下哪种试剂________
A. 浓硫酸 B.NaOH溶液 C.无水硫酸铜 D.新制氢氧化铜悬浊液
该反应的原理是____________________________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物完全燃烧生成标准状况下CO2的体积为4.48 L,H2O的质量为5.4 g ,
(1)若此有机物的质量为3 g,则此有机物的结构简式是_________________________;
(2)若此有机物的质量为4.6 g,则此有机物的分子式是________________________;
(3)若此有机物的质量为6.2 g,且此有机物1mol能和金属钠反应生成1 mol H2,则此有机物的结构简式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在日常生活和生产中有着重要的应用。下列说法不正确的是( )
A. 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32—水解
C. 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理
D. 纯碱溶液呈碱性的原因是CO32—+H2O![]() HCO3—+OH-
HCO3—+OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com