
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol,
2N2H4(g)+2NO2(g)=3N2(g) +4H2O(g) ΔH=-1135.7kJ/mol,
下列说法正确的是
A.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-1068 kJ/mol
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O=N2H5++ OH-
C.铂做电极,以KOH溶液为电解质溶液的肼—空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2↑+4H2O
D.铂做电极,以KOH溶液为电解质溶液的肼—空气燃料电池,工作一段时间后,KOH溶液的pH将增大
科目:高中化学 来源:2014高考名师推荐化学STS应用(解析版) 题型:选择题
人们日益重视环境问题,下列说法不正确的是
A.装饰装修材料中的甲醛、芳香烃及放射性物质都会造成室内污染
B.人类超量碳排放及氮氧化物和二氧化硫的排放是形成酸雨的主要原因
C.煤燃烧时加入少量的石灰石可以减少废气中的二氧化硫排放
D.我国自实施“限塑令”以来,“白色污染”在一定程度上得到有效遏制
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:简答题
A、B、C、D、E为原子序数依次增大的五种短周期元素。A和D最外层电子数相同;C、E最低负价相同。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的化合物甲和乙(相对分子质量甲<乙),D2C中阳离子与阴离子的电子层结构相同。请回答下列问题:
(1)B的氢化物与E的氢化物比较,沸点较高的是 (填化学式)。
(2)已知乙能与由A、C、D组成的化合物的溶液反应,请写出反应的离子方程式 。
(3)A、B两种元素可形成一种离子化合物,该离子化合物的电子式为 。
(4)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为____________。已知该盐溶液呈酸性,0.1mol·L-1该盐溶液中离子浓度由大到小的顺序是_________________________。
(5)化合物X、Y由A、C、D、E四种元素中的三种组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若X能抑制水的电离,Y能促进水的电离,则X与Y反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:选择题
氯碱工业常利用阳离子交换膜电解食盐水,下列说法不正确的是
A.随着电解的进行,c(NaCl)降低,需不断补充饱和食盐水
B.电解过程中采用增大阳极区溶液pH的方法,可以减少Cl2在水中的溶解量
C.阳离子交换膜的作用是阻止OH-移向阳极,以使氢氧化钠在阴极区富集
D.阳极表面用钛氧化物涂层处理,目的是降低电解产物Cl2对电极的腐蚀
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:填空题
【有机物化学基础】
肉桂酸甲酯( )又称苯基丙烯酸甲酯,具有可可香味,主要用于日化和食品工业,是常用的定香剂或食用香精,同时也是重要的有机合成原料。
)又称苯基丙烯酸甲酯,具有可可香味,主要用于日化和食品工业,是常用的定香剂或食用香精,同时也是重要的有机合成原料。
(1)有关肉桂酸甲酯的叙述中,正确的是 (填标号)。
A.肉桂酸甲酯的摩尔质量为163g/mol B.无法使酸性高锰酸钾溶液褪色
C.在碱性条件下能发生水解反应 D.能发生加聚反应生成高分子化合物
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如右图所示(图中球与球之间连线表示单键或双键)。G的结构简式为 。

(3)用芳香烃A为原料合成G的路线如下:
①化合物E中的官能团有 (填名称)。

②B→C该反应的化学方程式为 。
③A→B、E→F的反应类型是 、 。
④符合下列条件的F的同分异构体的结构简式是 。
a.分子内含苯环,且苯环上只有一个支链;
b.在一定条件下,l mol该物质与足量银氨溶液充分反应,生成4mol银单质。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:选择题
工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是
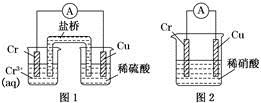
A.图1为原电池装置,Cu电极上产生的是O2
B.图2装置中Cu电极上发生的电极反应式为:Cu-2e-===Cu2+
C.由实验现象可知:金属活动性Cu>Cr
D.两个装置中,电子均由Cr电极流向Cu电极
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:简答题
【化学与技术】
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。

(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要 等原料。
(2)石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式为 。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有 (填化学式)等物质,该固体可用作生产水泥的原料。
(4)检验过滤Ⅰ所得滤液中含有CO32-的方法是 。
(5)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是 。
a.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒
(6)上述工艺流程中体现绿色化学理念的是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:简答题
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A、B与C;D、E与F分别位于同一周期。A原子L层上有3个未成对电子,B的简单负二价离子与C原子核外电子排布相同、含有D元素的盐的焰色反应火焰为黄色,EF3是由活泼金属和活泼非金属组成的共价化合物,G有多种氧化物,其中一种氧化物有磁性,填写下列空白
(1)元素的第一电离能最大的是________, 属于过渡元素的是________(填写元素符号)
(2)写出B元素的基态原子价电子排布式__________________,F离子电子排布式_________________。
(3)AF3分子中A原子的杂化类型是________,AF3分子的几何构型为___________。
(4)已知E2B3的晶格比DF的晶格能大得多,试分析导致两者晶格能差异的主要原因是:________________________________________________________。
(5)构成G晶体的微粒是________,G的晶胞结构如下图甲所示,G的晶胞为________结构。若G原子的半径为1.27×10-10 m,G金属晶体中的晶胞长度,即下图乙中AB的长度为________m。
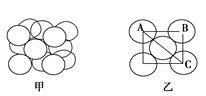
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
北京时间2012年9月14日,国外媒体报道,美国宇航局的“好奇”号火星车已经展开它的X射线分析器,并首次完成对火星物质元素成分的分析。下面这张图显示的是α粒子与X射线分光仪从某仪器获得的元素分析数据。多个峰值表明各种成分非常丰富,其中包括在火星大气里发现的氩,该仪器自身的铝,以及火星土壤微粒所含的硫黄和氯.
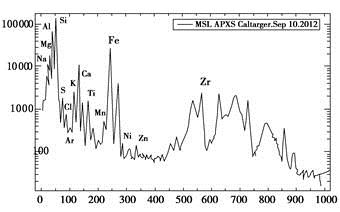
理解此图,判断下列说法错误的是
A.峰值最高的过渡元素在周期表中的位置是第四周期第Ⅷ副族
B.上述元素分析图中,同一周期的两种主族元素可形成1∶1型离子化合物只有一种,其电子式为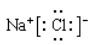
C .氯比硫的非金属性强的依据之一是HCl比H2S稳定
D.工业上常用电解氧化铝的方法制备铝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com