
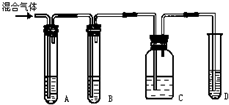
分析 乙炔不与NaOH溶液反应,但硫化氢能与碱反应,故乙炔的检验应放在排除硫化氢的干扰后进行,选通过硫酸铜溶液生成黑色沉淀检验硫化氢的存在;再通过NaOH溶液除去硫化氢,再通过硫酸铜溶液确认硫化氢已除干净.最后用高锰酸钾酸性溶液褪色实验检验乙炔,
(1)实验室制取乙炔常因含杂质生成少量H2S,实验以确证上述混合气体中含有乙炔和H2S,先检验硫化氢的存在用硫酸铜溶液检验,通过氢氧化钠溶液除去硫化氢,通过硫酸铜溶液检验硫化氢是否除净,最后用高锰酸钾溶液或溴水检验乙炔的存在,
(2)硫化氢是否存在可用硫酸铜溶液检验;
(3)装置B是除去硫化氢;
(4)利用硫酸铜溶液检验硫化氢是否除净;
(5)检验乙炔可以用溴水或高锰酸钾酸性溶液;乙炔和二氧化硫都能使溴水或高锰酸钾酸性溶液褪色.
解答 解:(1)实验室制取乙炔常因含杂质生成少量H2S,实验以确证上述混合气体中含有乙炔和H2S,先检验硫化氢的存在用硫酸铜溶液检验,通过氢氧化钠溶液除去硫化氢,通过硫酸铜溶液检验硫化氢是否除净,最后用高锰酸钾溶液或溴水检验乙炔的存在,如图所示A、B、C、D装置中可盛放的试剂是①、②、①、④或③,
故答案为:①;②;①;④或③;
(2)硫化氢是否存在可用硫酸铜溶液检验,能说明H2S气体存在的现象是生成黑色沉淀,CuSO4+H2S=CuS↓+H2SO4,
故答案为:装置A中有黑色沉淀;
(3)装置B是除去除去H2S气体,以免干扰乙炔的性质实验,
故答案为:除去H2S气体,以免干扰乙炔的性质实验;
(4)利用装置C中硫酸铜溶液的目的是检验硫化氢是否除净,若无黑色沉淀证明硫化氢除净,
故答案为:检验H2S是否除尽;
(5)检验乙炔可以用溴水或高锰酸钾酸性溶液,乙炔和二氧化硫都能使溴水或高锰酸钾酸性溶液褪色,确证含有乙炔的现象是装置C中没有黑色沉淀,装置D中的溶液褪色,
故答案为:装置C中没有黑色沉淀,装置D中的溶液褪色.
点评 本题考查乙炔的化学性质、制备以及常见气体的检验,题目难度中等,注意实验的先后顺序.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 加入少量稀硫酸 | B. | 加热 | ||
| C. | 加蒸馏水 | D. | 加入少量硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.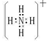 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是含有碳元素的化合物都属于有机物 | |
| B. | 大多数有机物都是由分子构成的 | |
| C. | 有机物都很容易燃烧 | |
| D. | 易溶于汽油、酒精、苯等有机溶剂中的物质,一定是有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
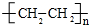 ,是塑料的主要成分:
,是塑料的主要成分: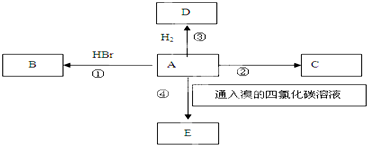
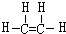 ,D的分子式为C2H6;D能在光照条件下与氯气发生取代反应
,D的分子式为C2H6;D能在光照条件下与氯气发生取代反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥⑦ | B. | ②③⑤⑦ | C. | ②⑤⑦ | D. | ②④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
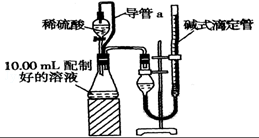 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com