
X、Y、Z、M、N代表五种金属,有以下化学反应:
①水溶液中:X+Y2+=X2++Y;
②Z+2H2O(冷)=Z(OH)2+H2↑;
③M、N为电极与N盐溶液组成原电池,负极反应为:M-2e-=M2+;
④Y可以溶于稀H2SO4中,M不能被H2SO4氧化,则这五种金属的活动性由弱到强的顺序是
| A.M<N<Y<X<Z | B.N<M<Y<X<Z |
| C.N<M<X<Y<Z | D.X<Z<N<M<Y |
B
解析试题分析:比较金属活泼性强弱,可根据金属之间的置换反应;与水、酸反应的剧烈程度;原电池的正负极,负极较活泼以及金属活动顺序表等,以此解答该题;①水溶液中:X+Y2+=X2++Y,可知活泼性为X>Y; ②Z+2H2O(冷水)=Z(OH)2+H2↑,说明Z为活泼性很强的金属,而其它反应在溶液中进行,说明其它金属与水不反应,则Z最活泼;③M、N为电极,与N盐组成原电池,电极反应为M-2e-=M2+,说明M为负极,活泼性为M>N;④Y可以溶于稀硫酸,M不被稀硫酸氧化,说明活泼性Y>M,则这五种金属的活动性由弱到强的顺序是N<M<Y<X<Z,选B。
考点:考查金属的活泼性的比较。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:单选题
短周期主族元素A、B、C、D的原子序数依次增大。A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
A.非金属性:A>C
B.原子半径:B<C<D
C.最高价氧化物对应水化物的酸性:D<C
D.单质B常温下能溶于浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
门捷列夫制作元素周期表时,许多元素尚未发现,他在铝的下面留了空位给“类铝”,并对“类铝”的性质进行了预测, “类铝”与后来发现的镓的性质一致,从而验证了元素周期表的正确性。下列有关镓的性质的描述中错误的是
| A.镓的金属性比铝弱 | B.镓的常见化合价为+3 |
| C.镓的原子半径比铝大 | D.镓的原子结构示意图为 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法正确的是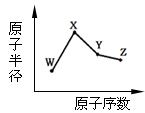
| A.对应简单离子半径:X>W |
| B.对应气态氢化物的稳定性Y>Z |
| C.化合物XZW既含离子键,又含共价键 |
| D.Y的氧化物能与Z的氢化物和X的最高价氧化物对应的水化物的溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于元素周期表的说法正确的是
| A.元素周期表中有8个主族 | B.元素周期表中有7个周期 |
| C.周期表中的主族都有金属元素 | D.IA族中的元素全部是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
国际纯粹与应用化学联合会(IUPAC)将117号元素暂时命名为Uus,以下关于Uus的叙述正确的是
A.是稀有气体 B.有放射性 C.是第六周期元素 D.质量数为117
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关元素的性质及其递变规律正确的是
| A.Ⅰ A族元素与ⅦA族元素间形成的化合物一定含离子键 |
| B.第二周期元素从左到右,最高正价从+1递增到+7,最低负价从—4升高到—1 |
| C.同主族非金属元素的简单阴离子还原性越强,其气态氢化物的稳定性越弱 |
| D.同周期主族金属元素的化合价越高,其原子失电子能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据中学化学教材所附元素周期表判断,下列叙述正确的是( )
| A.L电子层电子数为奇数的所有元素都是非金属 |
| B.第三、四、五、六周期元素的数目分别是8、18、32、32 |
| C.由左至右第8、9、10三列元素中没有非金属元素 |
| D.只有第ⅡA族元素的原子最外层有2个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com