
| A£® | ¢Ū | B£® | ¢Ł | C£® | ¢Ü | D£® | ¢Ś |
·ÖĪö »Æѧ·“Ó¦ĖŁĀŹÖ®±ČµČÓŚ»Æѧ·“Ó¦·½³ĢŹ½ÖŠµÄ»Æѧ¼ĘĮæŹżÖ®±Č£¬¾ł×Ŗ»ÆĪŖÓĆA±ķŹ¾µÄ·“Ó¦ĖŁĀŹ½ųŠŠ±Č½Ļ£®
½ā“š ½ā£ŗ»Æѧ·“Ó¦ĖŁĀŹÖ®±ČµČÓŚ»Æѧ·“Ó¦·½³ĢŹ½ÖŠµÄ»Æѧ¼ĘĮæŹżÖ®±Č£¬v£ØA£©£ŗv£ØB£©£ŗv£ØC£©£ŗv£ØD£©=3£ŗ1£ŗ2£ŗ2£¬Ōņ×Ŗ»ÆĪŖÓĆA±ķŹ¾µÄ»Æѧ·“Ó¦ĖŁĀŹ·Ö±šĪŖ£ŗ¢Łv£ØA£©=0.6 mol•L-1•min-1£»¢Śv£ØA£©=1.35 mol•L-1•min-1£»¢Ūv£ØA£©=0.022 5 mol•L-1•min-1£»¢Üv£ØA£©=0.675 mol•L-1•min-1£¬ĖłŅŌŌŚ²»Ķ¬Ģõ¼žĻĀ£¬·“Ó¦½ųŠŠ×īæģµÄŹĒ¢Ś£¬¹ŹŃ”D£®
µćĘĄ ±¾Ģāæ¼²é»Æѧ·“Ó¦ĖŁĀŹæģĀż±Č½Ļ£¬ÄŃ¶Č²»“ó£¬Ņ²æÉŅŌĄūÓĆĖŁĀŹÓė»Æѧ¼ĘĮæŹżµÄ±ČֵŊ¶Ļ£¬±ČÖµŌ½“ó±ķŹ¾·“Ó¦ĖŁĀŹŌ½æģ£¬×¢Ņā±£³Öµ„Ī»Ņ»ÖĀ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
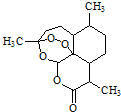
| A£® | ĒąŻļĖŲ·Ö×ÓŹ½ĪŖC15H20O5 | |
| B£® | æÉÓĆÕōĮóĖ®ĢįČ”Ö²ĪļÖŠµÄĒąŻļĖŲ | |
| C£® | ĒąŻļĖŲŌŚ¼īŠŌĢõ¼žĻĀŅ×·¢ÉśĖ®½ā·“Ó¦ | |
| D£® | ĒąŻļĖŲÓöŹŖČóµÄµķ·Ūµā»Æ¼ŲŹŌÖ½Į¢æĢĻŌĄ¶É«£¬ŹĒŅņĪŖ·Ö×Ó½į¹¹ÖŠŗ¬ÓŠõ„»ł |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
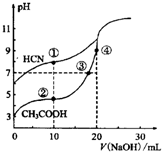
| A£® | µć¢ŁŗĶµć¢ŚĖłŹ¾ČÜŅŗÖŠ£ŗc£ØCH3COO-£©£¼c£ØCN-£© | |
| B£® | µć¢ŁŗĶµć¢ŚĖłŹ¾ČÜŅŗÖŠ£ŗc£ØCH3COO-£©-c£ØCN-£©=c£ØHCN£©-c£ØCH3COOH£© | |
| C£® | µć¢ŪŗĶµć¢ÜĖłŹ¾ČÜŅŗÖŠ£ŗc£ØNa+£©£¾c£ØOH-£©£¾c£ØCH3COO-£©£¾c£ØH+£© | |
| D£® | µć¢ŚŗĶµć¢ŪĖłŹ¾ČÜŅŗÖŠ¶¼ÓŠ£ŗc£ØCH3COO-£©+c£ØOH-£©=c£ØCH3COOH£©+c£ØH+£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĄķĀŪÉĻĖµ£¬ČĪŗĪÄÜ×Ō·¢½ųŠŠµÄŃõ»Æ»¹Ō·“Ó¦¶¼æÉÉč¼Ę³ÉŌµē³Ų | |
| B£® | ijŌµē³Ų·“Ó¦ĪŖCu+2AgNO3ØTCu£ØNO3£©2+2Ag£¬×°ÖĆÖŠµÄŃĪĒÅÄŚæÉŅŌŹĒŗ¬ĒķÖ¬µÄKCl±„ŗĶČÜŅŗ | |
| C£® | ŅņĪŖĢśµÄ»īĘĆŠŌĒæÓŚĶ£¬ĖłŅŌ½«Ģś”¢ĶÓƵ¼ĻßĮ¬½Óŗó·ÅČėÅØĻõĖįÖŠ×é³ÉŌµē³Ų£¬±ŲŹĒĢś×öøŗ¼«”¢Ķ×öÕż¼« | |
| D£® | CaO+H2OØTCa£ØOH£©2£¬æÉŅŌ·Å³ö“óĮæµÄČČ£¬¹ŹæÉ°ŃøĆ·“Ó¦Éč¼Ę³ÉŌµē³Ų£¬°ŃĘäÖŠµÄ»ÆѧÄÜ×Ŗ»ÆĪŖµēÄÜ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ļ”ĮņĖįÓėĒāŃõ»Æ±µČÜŅŗ·“Ó¦ | B£® | Ļ”ĻõĖįÓėÉÕ¼īČÜŅŗ·“Ó¦ | ||
| C£® | “×ĖįÓėĒāŃõ»Æ¼ŲČÜŅŗ·“Ó¦ | D£® | ŃĪĖįÓėĒāŃõ»ÆĢś·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
 2015Äź8ŌĀ12ČÕĢģ½ņøŪĢŲ“ó±¬ÕØŹĀ¹Ź£¬ŌŁŅ»“ĪŅż·¢ĮĖČĖĆĒ¶Ō»·¾³ĪŹĢāµÄ¹Ų×¢£®¾Ż²éĪ£»Æ²ÖæāÖŠ“ęÓŠ“óĮæµÄÄĘ”¢¼Ų”¢°×Į×£ØP4£©”¢ĻõĖįļ§ŗĶĒč»ÆÄĘ£ØNaCN£©£®
2015Äź8ŌĀ12ČÕĢģ½ņøŪĢŲ“ó±¬ÕØŹĀ¹Ź£¬ŌŁŅ»“ĪŅż·¢ĮĖČĖĆĒ¶Ō»·¾³ĪŹĢāµÄ¹Ų×¢£®¾Ż²éĪ£»Æ²ÖæāÖŠ“ęÓŠ“óĮæµÄÄĘ”¢¼Ų”¢°×Į×£ØP4£©”¢ĻõĖįļ§ŗĶĒč»ÆÄĘ£ØNaCN£©£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
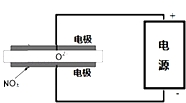
| A£® | Ńō¼«·“Ó¦ĪŖ£ŗFe-2e-ØTFe2+ | B£® | µē½ā¹ż³ĢÖŠpH²»±ä | ||
| C£® | ¹ż³ĢÖŠÓŠFe£ØOH£©3Éś³É | D£® | ÉĻŹö·“Ó¦ÖŠCr2O72-±»»¹Ō |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com